Chemistry ajuda-nos a compreender as propriedades e composição do mundo à nossa volta. Aqui você aprenderá sobre os estados da matéria, assim como muito sobre um estado em particular (três suposições – não é sólido ou líquido…).
Os estados da matéria
Dependente da temperatura, pressão e propriedades de uma substância, uma substância pode assumir diferentes formas físicas. Chamamos a estas formas físicas Estados da Matéria. Existem três estados da matéria muito bem conhecidos: Sólidos, Líquidos, e Gases. Outros estados da matéria também existem. Estes incluem o Plasma (um estado da matéria semelhante a um gás, mas contém elétrons e íons em movimento livre – átomos que perderam elétrons) e os Condensados de Bose-Einstein (BECs) (ondas de matéria que podem ocorrer com alguns tipos de átomos a temperaturas super frias).
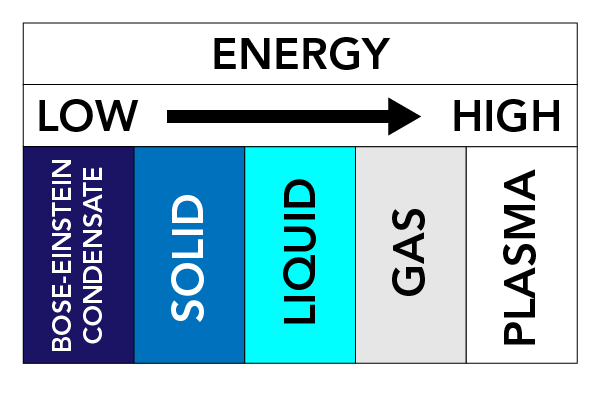
As forças entre as partículas e a pressão sobre as partículas mantêm as partículas juntas. Se aquecermos a matéria (adicionar energia), as partículas começam a mover-se mais rapidamente e tendem a espalhar-se entre si. Este movimento de partículas tem um grande efeito no estado de uma substância.
Sólidos
Em sólidos, as forças que mantêm as partículas juntas são relativamente fortes, e as partículas permanecem muito próximas umas das outras. As partículas podem vibrar mas não se movem muito. É por isso que os sólidos são duros e rígidos. Deixados sozinhos, os sólidos manterão a sua forma.
Líquidos
Em líquidos, as forças entre as partículas são mais fracas do que nos sólidos. As partículas ainda estão bastante próximas umas das outras, mas podem mover-se livremente. Líquidos podem fluir dentro de um recipiente, e não têm nenhuma forma fixa particular.
Gases
Gases são difíceis de relacionar porque são muitas vezes invisíveis, mas encontrados em toda a volta. Você pode senti-los quando, por exemplo, o vento sopra. Você pode às vezes senti-los quando, por exemplo, você sente o cheiro de comida que está cozinhando, ou quando um gambá foi perturbado. Alguns gases são importantes para a nossa saúde (por exemplo, oxigénio) enquanto outros podem ser mortais (por exemplo, sulfureto de hidrogénio e cloro). Antes da cirurgia, você pode receber um gás anestésico, que contém produtos químicos, para aliviar a dor e deixá-lo inconsciente durante o procedimento. Os gases também são responsáveis pela força das explosões. Vamos dar uma olhada nos gases.
Tipos de Gases
Existem gases elementares (constituídos por um único elemento) e gases que são compostos (constituídos por mais de um elemento). Os símbolos dos gases elementais podem ser encontrados em qualquer Tabela Periódica de Elementos. Eles estão resumidos no gráfico abaixo.
Gás diatómico |
Fórmula química |
Monatómico Gás |
Fórmula Química |
|
Hidrogénio > |
H2 > |
Helium |
He |
Oxygen |
O2 |
Neon |
>
Ne |
Nitrogénio |
N2 |
Argon |
>
Ar > |
Fluorine |
F2 |
Krypton |
>
Kr |
Cloro |
Cl2 |
Xénon |
Xe |
Um gás diatómico é aquele em que a unidade básica é uma molécula feita de dois átomos unidos entre si. Um gás monatómico é aquele em que a unidade básica é um único átomo. A maioria dos gases, contudo, são compostos com dois ou mais elementos diferentes quimicamente unidos. O mais comum é o vapor de água, H2O. Aqui estão os nomes, fórmulas e usos de alguns gases compostos:
Nome Comum |
Fórmula Química |
Onde você normalmente encontrá-lo |
Dióxido de carbono |
>CO2 |
Atmosfera, escape do carro, pop, nossos pulmões |
|
Propano |
C3H8 |
>
BBBQs, fogões de acampamento, combustível para alguns veículos |
Metano |
>
CH4 |
Componente de estufa gás e gás natural |
Ammonia |
>
NH3 |
Utilizado para fazer fertilizantes, produtos de limpeza |