Uma pessoa precisa conhecer algumas propriedades básicas do composto dado e sua estrutura Lewis para entender sua geometria molecular, polaridade, e outras propriedades semelhantes. O SF4 é uma fórmula química para o Tetrafluoreto de Enxofre. É um gás corrosivo incolor que é utilizado na síntese de vários compostos organofluorídricos. O SF4 é um composto bastante perigoso, mas é amplamente utilizado em empresas químicas e farmacêuticas.
| Nome da molécula | Tetrafloreto de enxofre ( SF4) |
| Número de elétrons de valência na molécula | 34 |
| Hibridação de SF4 | sp3 hibridação |
| Ângulos de ligação | 102 graus e 173 graus |
| Geometria molecular de SF4 | Trigonal bipiramidal |
Para compreender as propriedades desta molécula, como a sua reactividade, polaridade e mais, é preciso conhecer primeiro a estrutura do SF4 Lewis.
Conteúdo
Geometria Molecular SF4
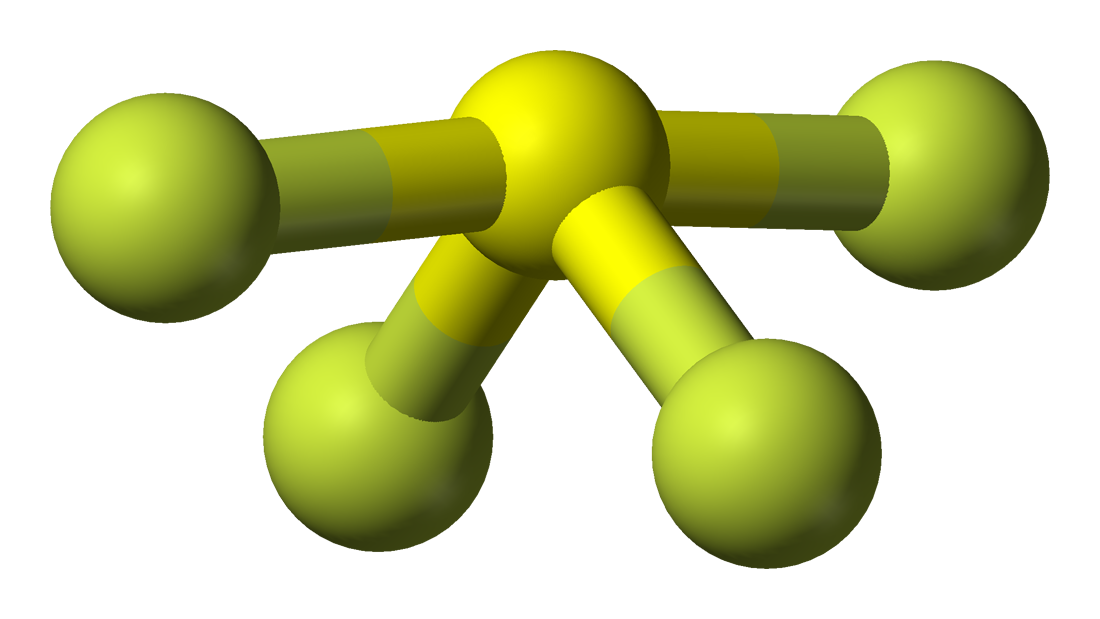
É fácil compreender a geometria molecular de uma determinada molécula usando a fórmula molecular ou modelo VSEPR. Uma fórmula molecular ajuda a saber o número exato e o tipo de átomos presentes no composto em questão. Aqui há um átomo de enxofre e quatro átomos de flúor no composto, o que o torna semelhante à fórmula molecular do AX4E.
Moléculas com fórmula molecular de AX4E têm geometria molecular bipiramidal trigonal. Aqui dois átomos de flúor formando ligações com o átomo de enxofre estão nas posições equatoriais, e os dois restantes estão nas posições axiais. Como há um par único no átomo central, ele repele o par de elétrons de ligação, o que afina um pouco a forma e a faz parecer como uma serra de serra. Os electrões seguem este padrão de disposição seguindo a regra VSEPR para minimizar as forças de repulsão entre os pares solitários de electrões para maximizar a estabilidade da molécula.
Hence, SF4 tem uma geometria molecular bipiramidal trigonal.
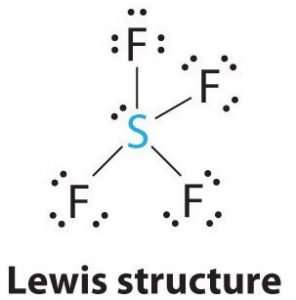
SF4 Lewis Structure
Lewis structure is a pictorial representation of the bonds and valence electrons in the molecule. As ligações formadas entre dois átomos são representadas por linhas, enquanto os elétrons de valência que não formam nenhuma ligação são mostrados por pontos. Os elétrons de valência que participam na formação de ligações são chamados pares de elétrons de ligação, enquanto os elétrons que não participam ou não formam nenhuma ligação são chamados pares de elétrons sem ligação ou pares solitários.
E para desenhar a estrutura de Lewis do SF4, precisamos primeiro saber o número total de elétrons de valência nesta molécula.
Como provavelmente se pode ver, há um átomo de enxofre neste composto e quatro átomos de flúor. Para conhecer o total de electrões de valência deste composto, precisamos de conhecer os electrões de valência de ambos os átomos individualmente.
- Elétrões de valência de enxofre: 6
- Elétrões de valência de flúor: 4* (7)
( como há quatro átomos de flúor, temos que considerar elétrons de valência de todos os átomos)
Número total de elétrons de valência em SF4 = número de elétrons de valência em enxofre + número de elétrons de valência em flúor
>
= 6 + 28
>
= 34 elétrons de valência
Agora sabemos o número total de elétrons de valência, tornar-se-ia fácil para nós compreender também a formação da ligação entre os átomos e a disposição completa da molécula.
Sulfur será o átomo central desta molécula, pois é o menos electronegativo, com quatro átomos de flúor a formarem ligações nos lados deste átomo central. Cada átomo de flúor formará uma ligação com o átomo central, o que significa que haverá quatro ligações na estrutura da molécula usando até quatro elétrons de valência de átomos de flúor e 4 elétrons de átomos de enxofre. Portanto, agora são usados oito elétrons de valência, reduzindo o número de elétrons de valência de 34 para 24. Todos os átomos de flúor têm seis elétrons de valência, e o átomo central tem dois elétrons de valência.
Destaque linhas entre S e F para mostrar ligações e para pares solitários de elétrons, use pontos. Cada átomo de flúor terá três pares de 6 elétrons de valência (mostrados como pontos) no átomo, juntamente com uma ligação com enxofre. Em contraste, o átomo central terá dois elétrons de valência e quatro ligações.
Hence, o átomo central, enxofre, terá um par único de elétrons e quatro pares de ligações na estrutura de Lewis do SF4. Ao mesmo tempo, cada átomo de flúor terá três pares solitários.
O SF4 é polar?
Após conhecermos a estrutura de Lewis e a geometria molecular do composto dado, torna-se mais fácil retratar a polaridade da molécula. Aqui, um par único no átomo central de enxofre e quatro pares de electrões de ligação conduzem à distribuição assimétrica dos electrões no átomo central.
>
Também, como a forma da molécula é como uma serra de ver, dois átomos de flúor podem cancelar o momento dipolo um do outro, mas os outros dois não podem devido à disposição dos electrões. E como os átomos de flúor são mais electronegativos que o átomo de enxofre, resulta numa distribuição desigual da carga. Assim, o momento dipolo não é cancelado, o que torna a molécula polar. Então sim, o SF4 é polar.
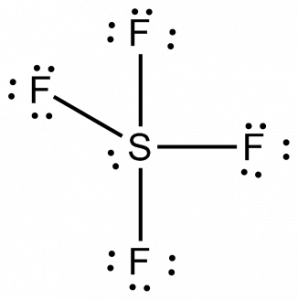
SF4 Hibridação
Para conhecer a hibridação da molécula de SF4, vamos primeiro olhar para as regiões de densidade de elétrons para o átomo central.
Sulfur tem quatro pares de electrões de ligação e um único par, fazendo o seu número total de regiões para a densidade de electrões 5. Assim, o átomo de enxofre usa cinco orbitais hibridizados, um orbital 3s, três orbitais 3p e um orbital 3d. Esta disposição de elétrons ao redor do átomo e orbitais hibridizados leva à hibridização sp3d. Também se pode usar o número estéreo para conhecer a hibridação; aqui, o número estéreo é 5 para o átomo de enxofre.
Assim o SF4 tem a hibridação sp3d.
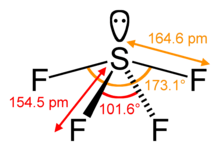
SF4 ângulos de ligação e forma
O átomo central de enxofre forma quatro ligações com os átomos de flúor vizinhos e tem um único par de electrões. Os átomos de flúor nas posições equatoriais têm ângulos de ligação de 102 graus e os axiais de 173 graus, que são um pouco diferentes da geometria molecular bipiramidal trigonal, levando a uma forma de serra vertical.
O par único no átomo central leva à mudança nos ângulos de ligação de 120 graus para 102 graus para átomos de flúor equatoriais e 173 graus em vez de 180 graus para átomos de flúor axiais.
Observações Finais
Para concluir todas as propriedades podemos dizer que,
- Tetrafluoreto de enxofre tem 34 elétrons de valência, dos quais forma quatro ligações covalentes e um par único de elétrons no átomo central em sua estrutura Lewis.
- Existem três pares solitários em cada átomo de flúor.
- Tetrafluoreto tem uma geometria molecular da fórmula AX4E; forma uma forma de serra vertical e tem uma geometria molecular bipiramidal trigonal.
- SF4 tem hibridização sp3d e é polar na natureza.