O Flaviviradae é uma grande família de patógenos virais responsáveis por causar doenças graves e mortalidade em humanos e animais. A família é constituída por três gêneros: Flavivírus, Pestivírus e Hepacivírus. O gênero Flavivirus, que é o maior dos três, contém mais de 70 vírus, incluindo o Vírus da Dengue (DV), Vírus da Encefalite Japonesa (JEV), Vírus do Nilo Ocidental (WNV), Vírus da Febre Amarela (YFV) e Vírus Zika (ZIKV). Os Flavivírus mostram uniformidade morfológica com uma capa icosaédrica e um envelope fechado, com espigões. O tamanho da cápsula é de cerca de 30 nm e o virião inteiro mede 45 nm. O genoma dos flavivírus é um RNA de sentido singlanded cerca de 10 kb de tamanho. Ele codifica 3 proteínas estruturais: capsid (proteína C), membrana (M, que é expressa como prM, o precursor de M e envelope (proteína E) e 7 proteínas não-estruturais: NS1, NS2A, NS2B, NS3, NS4A, NS4B e NS5 (Figura 1 a.b).
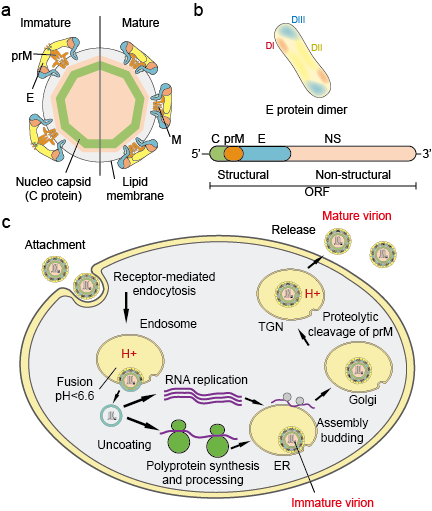
Figure 1. Partículas de Flavivirus (a), proteínas (b) e ciclo de vida (c).
Pesquisa de todos os produtos relacionados ao Flavivirus
Ciclo de vida do Flavivirus:
Virions attach to the surface of a host cell and subsequently enter the cell by receptor-mediated endocytosis (Figura 1c). Foram identificados vários receptores primários e co-receptores de baixa afinidade para os flavivírus. A acidificação da vesícula endossômica desencadeia alterações conformacionais no virião, fusão das membranas celular e viral, e desmontagem de partículas. Uma vez que o genoma é liberado no citoplasma, o RNA de sentido positivo é traduzido em uma única poliproteína que é processada co- e pós-tradução por proteases virais e hospedeiro. A replicação do genoma ocorre em membranas intracelulares. A montagem do vírus ocorre na superfície do retículo endoplasmático (RNA) quando as proteínas estruturais e as gemas de RNA recém-sintetizadas entram no lúmen do RNA. As partículas resultantes não infecciosas, imaturas, virais e subvirais são transportadas através da rede trans-Golgi (TGN). As partículas imaturas de virião são clivadas pela protease furina hospedeira, resultando em partículas maduras e infecciosas. As partículas subvirais também são clivadas pela furina. Viriões maduros e partículas subvirais são subsequentemente libertados pela exocitose.
Epidemiologia do vírus flavívoro:
Slavivírus Mosquito são transmitidos na natureza em um ou mais ciclos distintos ou sobrepostos que incluem um mosquito vector, geralmente mosquitos Aedes para YFV e DENV e mosquitos Culex para JEV e WNV, e um hospedeiro mamífero ou aviário. A transmissão entre mosquitos e hospedeiros de vertebrados é chamada transmissão horizontal e causa doenças em vertebrados. Em contraste com a transmissão horizontal, os flavivírus transmitidos por mosquitos podem ser mantidos no ambiente através de transmissões verticais, ou seja, transgeracionais, que permitem a propagação dos flavivírus apenas em mosquitos. A evidência mais directa que suporta a transmissão vertical dos flavivírus transmitidos por mosquitos deriva do isolamento do vírus das larvas infectadas presumivelmente através da transmissão transovarial. Esta observação é consistente com a detecção de antígenos virais em tecidos ovarianos de mosquitos infectados. (Figura 2)
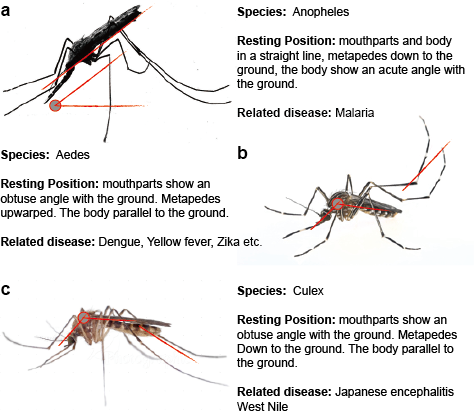
>
Figure 2. Três mosquitos típicos que transmitem a doença
Flavivírus têm uma distribuição global, e alguns membros do gênero constituem um importante problema de saúde pública (por exemplo, o vírus da febre amarela , dengue, Nilo Ocidental e encefalite japonesa), com alta morbidade e/ou mortalidade. Na última década, os flavivírus têm demonstrado uma prevalência crescente, representando um risco para mais de 3 bilhões de pessoas em todo o mundo, o que os torna um paradigma de doenças emergentes.
Nos últimos 50 anos, muitos flavivírus, como o dengue, o vírus do Nilo Ocidental e o vírus da febre amarela, exibiram aumentos dramáticos na incidência, gravidade da doença e/ou amplitude geográfica. Os patógenos virais derivados do meio ambiente apresentam características epidemiológicas relativamente uniformes. Mosquitos, carrapatos e moscas que picam servem como vetores para a maioria das doenças virais humanas. A doença humana ocorre quando os vetores são ativos, tipicamente na primavera, verão e outono em climas temperados, e freqüentemente exibe características epidemiológicas distintas que correspondem ao habitat do vetor (Figura 3).
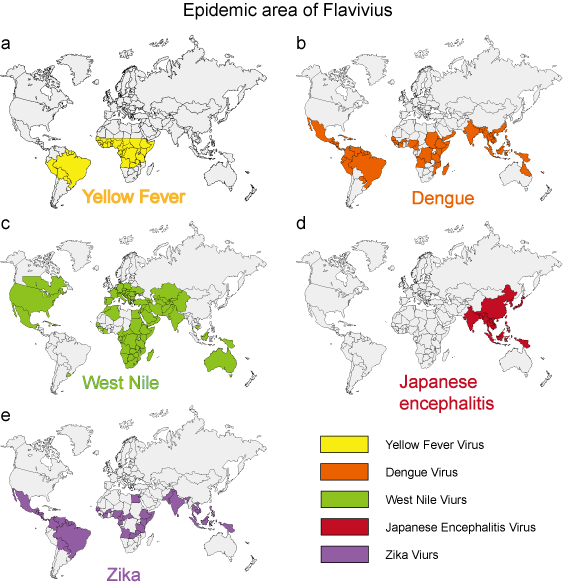
Figure 3. A área epidêmica de 5 flavivírus típicos.
Manifestações:
Flavivírus variam amplamente em seu potencial patogênico e mecanismos de produção de doenças humanas (Tabela 1). A infecção humana tanto com flavivírus transmitidos por mosquitos como por carrapatos é iniciada pela deposição do vírus através da pele através da saliva de um artrópode infectado. O vírus replica-se localmente e nos linfonodos regionais e resulta em viremia. As principais síndromes e exemplos de flavivírus causadores incluem: encefalite (encefalite japonesa), doença febril com erupção cutânea (vírus do dengue), febre hemorrágica (vírus da doença de Kyasanur Forest e às vezes vírus do dengue) e febre hemorrágica com hepatite (vírus da febre amarela).
Quadro 1 Visão geral dos Flavivírus mais importantes
| Espécies virais | Vector transmissor | Distribuição geográfica | Síndrome |
|---|---|---|---|
| Febre amarela | Mosquito (Aedes) | Ver Figura 3a | Febre hemorrágica |
| Dengue | Mosquito (Aedes, Estegomyia) |
Ver Figura 3b | Síndrome de dengue, DHF, DSS |
| Febre do Nilo Ocidental | Mosquito (Culex), paus (Argasidae) |
Ver Figura 3c | Síndrome de Dengue, encefalite |
| Encefalite japonesa | Mosquito (Culex) | Ver Figura 3d | Encefalite |
| Zika | Mosquito (Aedes) | Ver Figura 3e | Microcefalia |
Diagnósticos:
O diagnóstico clínico dos diferentes flavivírus não é confiável devido aos sintomas inespecíficos, e o diagnóstico laboratorial é obrigatório para confirmar a etiologia da doença. Nas infecções por flavivírus, o vírus pode ser encontrado em soro ou plasma, geralmente 2-7 dias após o início da doença, e a duração desta fase virêmica e a carga viral detectada varia de acordo com o vírus infectante (Tabela 2). Geralmente, após 5-7 dias após o início, surge uma resposta imunológica contra a infecção, com o pico de anticorpos IgM após 15 dias. Estes anticorpos IgM podem durar de meses (como no caso do DENV) a anos (como no caso das infecções por WNV). O aparecimento de IgG ocorre após 8-10 dias desde o início e pode ser detectado ao longo da vida. As características particulares de cada flavivírus influenciam marcadamente os algoritmos de diagnóstico a serem aplicados na identificação de infecções por flavivírus. Em geral, muitos laboratórios escolheram testes serológicos para diagnosticar infecções causadas por flavivírus, devido à sua precisão e à disponibilidade de testes comerciais baseados em elevados padrões de qualidade. No entanto, a presença de reações serológicas cruzadas entre os diferentes vírus e o tempo necessário para detectar os anticorpos em algumas infecções, dificultam a utilidade da serologia como ferramenta de diagnóstico das infecções agudas por flavivírus. O isolamento viral constitui o método ‘padrão-ouro’ para alcançar um diagnóstico confirmado de flavivírus.
Passar todos os Flavivirus ELSIA Kit e Flavivirus RDT Produtos
Tabela 2. Algoritmos de diagnóstico de Flavivírus.
| Fase aguda | Fase convalescente | Preferido sample† | Carga viral esperada | |
|---|---|---|---|---|
| YFV | RT-PCR, RT-qPCR, IgM, isolamento de vírus | IgM, IgG | Soro, plasma e tecido | Alto |
| DENV | RT-PCR, RT-qPCR, NS1 Ag, IgM, isolamento de vírus | IgM, IgG | Soro, plasma, CSF e PBMCs | Up a 106 viriões/ml |
| WNV | RT-PCR, IgM, IgG | IgM, IgG | CSF e soro | Baixo |
| JEV | RT-PCR, IgM, IgG | IgM, IgG | CSF, soro, sangue e PBMCs | Baixo |
| ZIKV | RT-PCR, IgM, IgG | IgM, IgG | CSF e soro | Baixo |
| Gould E A, Solomon T. flavívoros patogênicos . The Lancet, 2008, 371(9611): 500-509. | |
| Gaunt M W, Sall A A, de Lamballerie X, et al. As relações filogenéticas dos flavivírus correlacionam-se com a sua epidemiologia, associação de doenças e biogeografia . Journal of General Virology, 2001, 82(8): 1867-1876. | |
| Kuno G, Chang G J J J, Tsuchiya K R, et al. Phylogeny of the genus Flavivirus . Journal of virology, 1998, 72(1): 73-83. | |
| Mukhopadhyay S, Kuhn R J, Rossmann M G. Uma perspectiva estrutural do ciclo de vida dos flavivírus. Nature Reviews Microbiology, 2005, 3(1): 13-22. | |
| Huang Y J S, Higgs S, Horne K M E, et al. Interacções flavivírus-mosquito. Vírus, 2014, 6(11): 4703-4730. |