A sulfonação do metilbenzeno
O metilbenzeno é mais reactivo que o benzeno devido à tendência do grupo metilo para “empurrar” electrões em direcção ao anel.
O efeito desta maior reactividade é que o metilbenzeno reagirá com ácido sulfúrico fumante a 0°C, e com ácido sulfúrico concentrado se forem aquecidos sob refluxo durante cerca de 5 minutos.
Como também o efeito na taxa de reacção, com o metilbenzeno também se tem de pensar onde o grupo ácido sulfónico acaba no anel em relação ao grupo metilo. Os grupos metilo têm tendência para “dirigir” novos grupos para as posições 2 e 4 no anel (assumindo que o grupo metilo está na posição 1). Diz-se que os grupos metilo são 2,4-direccionados.
Então você obtém uma mistura que consiste principalmente de dois isómeros. Apenas cerca de 5 – 10% dos 3 isómeros são formados. As principais reacções são:
![]()
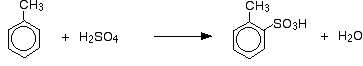
e:
![]()
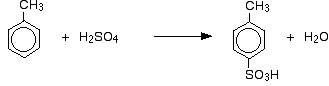
No caso da sulfonação, a proporção exacta dos isómeros formados depende da temperatura da reacção. À medida que a temperatura aumenta, você obtém proporções crescentes do 4- isômero e menos do 2- isômero. Isto é porque a sulfonação é reversível. O grupo de ácido sulfônico pode cair do anel novamente, e voltar a se unir em outro lugar. Isto tende a favorecer a formação do isómero mais estável termodinamicamente. Este intercâmbio acontece mais a temperaturas mais elevadas.
O isómero 4- é mais estável porque não há desordem na molécula como haveria se o grupo metilo e o grupo ácido sulfónico estivessem um ao lado do outro.