Introdução
Esta neoplasia, que tem origem no epitélio dos ductos biliares, ou colangiocarcinoma (CC), representa 10% dos tumores hepatobiliares e 2% dos tumores malignos.1,2 O CC pode ser dividido em 3 subtipos, dependendo da sua origem anatômica dentro do ducto biliar: CC intra-hepático ou periférico (ICC), CC perihilar ou tumor de Klatskin (PHC) e CC distal.
PHC, que é o objeto desta revisão, é o mais freqüente, e representa cerca de 40%-60% de todo o CC.2,3 Este tumor é agressivo e silencioso, com sintomas inespecíficos até estágios avançados, levando ao diagnóstico tardio e à curta sobrevida sem cirurgia de 6 a 12 meses.4 A cirurgia, que é a única opção curativa disponível, só é possível em aproximadamente 47% dos pacientes no momento do diagnóstico.5-8 Os fatores prognósticos mais importantes para este tumor estão geralmente associados às opções cirúrgicas, sendo o estágio, tamanho, gânglios e envolvimento vascular, metástase intra-hepática e tipo histológico os fatores mais importantes.9-11
Espaço anatômico
O espaço anatômico ocupado pela CC seria delimitado pela entrada do ducto cístico a nível distal e pela bifurcação dos ductos hepáticos direito e esquerdo a nível proximal.1,12 As classificações mais utilizadas incluem todas as CC que se originam na confluência biliar ou no seu entorno. Alguns grupos têm sugerido que o CC originário do parênquima hepático às vezes pode invadir a confluência biliar, com origem no espaço anatômico delimitado pela fonte do ramo posterior da veia porta direita e do ligamento falciforme.13-15 Esse CCI envolvendo a confluência biliar seria tratado da mesma forma que os tumores de origem extra-hepática, sendo a sobrevida semelhante à PHC no mesmo estágio. São geralmente tumores altamente desenvolvidos com invasão vascular locorregional e linfonodal. Dúvidas sobre o comportamento biológico destes tumores levaram muitos grupos a excluí-los dos tumores perihilares. Em um estudo publicado por Ebata et al.13,15 de 250 pacientes ressecados para CC com envolvimento da confluência, o estágio e a sobrevida foram analisados de acordo se o tumor era intra-hepático com envolvimento da confluência (ICC), ou se a origem do tumor estava no ducto biliar extra-hepático (PHC). Um total de 83 pacientes apresentavam ICC e 167 PHC. Quando comparados os estágios, os pacientes com ICC apresentaram maior freqüência de envolvimento vascular e linfonodal, com um TNM maior que o do grupo de APS, apresentando estágios iii e iv em 59% dos casos, em comparação com 38% no grupo de APS. Entretanto, se a sobrevida é dividida por estágios em ambos os grupos, não há diferenças estatisticamente significativas aos 5 anos, com sobrevida global ligeiramente maior no grupo de APS (20% vs 29%, respectivamente; P=,057), de modo que se concluiu que eles são comparáveis em termos de tratamento e sobrevida. Com a melhoria dos testes diagnósticos e do conhecimento histopatológico, no futuro poderemos definir melhor se são 2 entidades distintas ou se são clínica e biologicamente iguais.
Características histopatológicas
90% da APS são adenocarcinomas. 10% são carcinomas adenosquamosos ou escamosos, que em alguns casos têm sido associados a um histórico de litíase, cistos ou anomalias dos ductos biliares. De acordo com o aparecimento do tumor, tipo de crescimento e comportamento biológico e clínico da PHC, eles são classificados como16,17:
- –
Tumor ou “formação de massa” CC: esta é a forma de apresentação mais comum na ICC, embora também possa ser encontrada em um grande número de PHC. Caracteriza-se pela formação de uma massa tumoral com margens claramente definidas. Tem uma grande reacção fibrótica e a necrose central também é frequente. Este tumor tem origem na abertura do ducto biliar, invadindo a parede e disseminando-se através do crescimento tridimensional, formando uma massa nodular que dá origem a sintomas obstrutivos.16-19
- –
Ctrl: tumores deste tipo crescem ao longo de um ducto biliar sob a forma de um espessamento concêntrico longitudinal através do tecido conjuntivo ao redor do ducto, causando estenose ou obstrução completa do ducto biliar afetado.19 A maioria das PHC são deste tipo e são difíceis de identificar utilizando técnicas de imagem.17
- –
Capilar intraductal ou intraductal: esta variedade caracteriza-se pela presença de tumores superficiais e intraluminais no ducto biliar. Eles produzem mucina e causam a obstrução e dilatação parcial dos ductos.16 Este tumor tem um baixo grau de malignidade e é geralmente pequeno em tamanho, embora possa se espalhar através do muco biliar, dando origem a múltiplos tumores (papilomatose ou carcinomatose papilar).20
A importância desta diferenciação está nas variações de sobrevivência dependendo do subtipo em questão. Vários estudos têm demonstrado que pacientes do tipo papilar intraductal têm melhor prognóstico do que aqueles com as variedades esclero-nodular21, com sobrevida média de 55 e 33 meses, respectivamente,22 enquanto o envolvimento vascular e ganglionar são menos freqüentes no subtipo papilar intraductal.
Em resumo, a maioria da APS é adenocarcinoma com um padrão de crescimento periductal que lhes dá um pior prognóstico, enquanto a variante com crescimento intraductal é a menos freqüente, embora tenha melhor prognóstico.
Sistemas de estadiamento
Sistemas de estadiamento para APS podem ser diferenciados em classificações pré e pós-operatórias. Das primeiras, que são utilizadas no planejamento cirúrgico, o sistema mais importante é a classificação de Bismuto-Corlette. Isto indica qual lóbulo é preferencialmente afetado e, portanto, mostra o tipo de hepatectomia que deve ser utilizada (Fig. 1).23 Esta classificação foi inventada nos anos 70 e não leva em conta o envolvimento dos gânglios linfáticos nem a metástase, de modo que agora tem menor valor prognóstico.
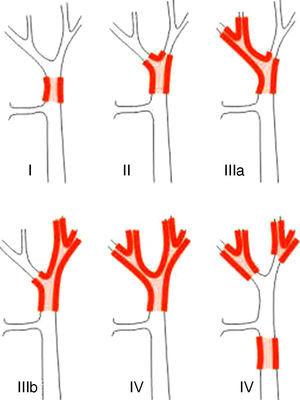
A classificação de Bismuto-Corlette23.
Outra classificação pré-operatória utilizada nos EUA é a publicada por Jarnagin et al.10 do Memorial Sloan Kettering Cancer Centre, New York. Esta classificação visa prever a ressecabilidade dos tumores, levando em conta 3 fatores locais de extensão. Estes são extensão biliar, envolvimento vascular e atrofia do lóbulo. Esta classificação não leva em conta o envolvimento dos gânglios linfáticos nem a metástase, de modo a ter menos valor prognóstico. Como a resectabilidade difere de grupo para grupo, enquanto a tendência é para tratamentos cada vez mais agressivos, seu valor dependerá dos critérios de não-resectabilidade de cada centro. O envolvimento local não deve agora ser critério de não espectabilidade, desde que se consiga obter um R0 com ressecção cirúrgica.
Das classificações pós-operatórias, a mais utilizada é a classificação TNM da Union for International Cancer Control (UICC), sétima edição.12 Esta classificação leva em conta dados patológicos, como extensão local, envolvimento vascular, envolvimento de linfonodos e metástase, para estabelecer uma classificação que inclui a extensão do tumor e é prognóstico na natureza.
Recentemente o “Grupo de Estudos Japoneses sobre Colangiocarcinoma Perihilar” (JSGPH) publicou um estudo que propôs a modificação da classificação da “União para o Controle Internacional do Câncer”. As diferenças básicas são mostradas na Tabela 1, e consistem principalmente em13:
-
Não considerando Bismuto IV como sendo T4. A classificação do JSGPH, portanto, não leva em conta a extensão biliar bilateral como um mau prognóstico se uma ressecção R0 for alcançada.
-
No que diz respeito aos estágios, prioriza o envolvimento dos gânglios linfáticos como o pior prognóstico. Portanto, consideram o envolvimento dos gânglios linfáticos como o estádio iva e não iiib (TNM7).
Comparação das Diferenças Básicas entre a Classificação TNM 7 da UICC e a Proposta do JSGPH.
| Classificação de rumores | UICC | Proposta do JSGPH |
|---|---|---|
| Tis | Carcinoma in situ | |
| T1 | Tumor confinado ao ducto biliar | |
| T2a | Envolve a parede da conduta e invade o tecido adiposo perihilar | |
| T2b | Invade o parênquima hepático | |
| T3 | Invasão unilateral da artéria/veina hepática | |
| T4 | Invasão do ramo principal do HA/PV, Bismuto IV, ou Bismuto III com invasão contralateral do A/V | Invasão vascular da principal marca do HA/PV, com invasão vascular bilateral ou contralateral |
| TNM estágio | ||
| 0 | Tis N0 M0 | |
| I | T1 N0 M0 | |
| II | T2 N0 M0 | |
| IIIa | T3 N0 M0 | |
| IIIb | T1-3 N1 M0 | T4 N0 M0 |
| Iva | T4 N× M0 | T× N1 M0 |
| Ivb | T× N× M1 | |
HA, artéria hepática; JSGPH, Grupo de Estudo Japonês sobre Colangiocarcinoma Perihilar; TNM, metástase tumoral linfonodal; UICC, Union for International Cancer Control; PV, veia portal.
A nível europeu, foi criado um registo internacional de tumores perihilares tratados cirurgicamente, liderado pelo “International Cholangiocarcinoma Group for the Staging of PHC”. Este grupo publicou uma nova classificação1 que leva em conta o tamanho do tumor, bem como o envolvimento biliar, venoso, arterial, ganglionar e metastático, tanto no pré-operatório como no pós-operatório. No entanto, as restrições desta classificação são que ela apenas descreve as características tumorais e a cirurgia a ser realizada, sem passar a dividir os pacientes em grupos ou estágios de acordo com estas variáveis. Como resultado, não é possível extrair conclusões prognósticas e também é impossível comparar os resultados de diferentes grupos.
Publicações anteriores mostram que a classificação pré-operatória mais utilizada atualmente para decidir o tipo de ressecção é Bismuth-Corlette, enquanto a classificação TNM 7 é utilizada para definir o prognóstico a longo prazo.
Estratégias de diagnóstico
Os sintomas associados à PHC são mais freqüentemente: icterícia (90%), perda de peso e dor abdominal (35%), prurido (26%) e colangite aguda (10%).17 Devido a estes sintomas o diagnóstico inicial é geralmente feito por ultrassonografia abdominal, sendo este um bom teste de triagem. Outros testes diagnósticos para este tipo de tumor seriam:
- –
Abdominal Doppler Ultrasound: permite avaliar a permeabilidade arterial e portal (trombose), o que pode condicionar a ressecabilidade do tumor e a estratégia terapêutica, embora não seja o teste de escolha para a avaliação do comprometimento vascular.
- –
Tomografia axial computadorizada abdominal: é útil para o diagnóstico do tumor primário e da extensão da doença, com 80% de sensibilidade na avaliação da extensão biliar. É a técnica de escolha para avaliação pré-operatória da anatomia vascular, com uma sensibilidade de 93% e 87% para avaliação do envolvimento arterial e portal, respectivamente. Possui baixa sensibilidade para a avaliação pré-operatória do comprometimento linfonodal (50%).14,24 Também é útil na realização de testes volumétricos e no cálculo do volume hepático remanescente após a ressecção cirúrgica. É também o exame mais econômico para estadiamento pré-operatório.
- –
Ressonância magnética e colangiografia de ressonância magnética (colangiografia RM): o melhor exame para o diagnóstico do tumor primário e para avaliar a extensão biliar. Tem uma sensibilidade de 86%-100% e é melhor que a colangiografia direta, sendo também um exame não-invasivo.25 Por outro lado, tem baixa sensibilidade para avaliação do comprometimento vascular (73%) e sensibilidade de 80% para invasão do parênquima hepático.
- –
Colangiografia direta: colangiopancreatografia retrógrada endoscópica (ERCP) e colangiopancreatografia hepática transparietal (TPHC): estas nos informam sobre o nível de obstrução biliar e possibilitam a coleta de amostras da lesão para citologia, com sensibilidade de 20%. Foram agora substituídas no diagnóstico pela colangiografia por RM. São muito úteis na drenagem biliar pré-operatória e no tratamento paliativo da HPPC, com a inserção de stents preferencialmente revestidos de metal.26-28
- –
Sonografia endoscópica: útil para a avaliação do envolvimento de gânglios na área do tronco celíaco e região peripancreática, estabelecendo estadiamento pré-operatório e possibilitando a realização de biópsias de aspiração com agulha fina.
- –
Tomografia por emissão de pósitrons: é útil no estudo de pacientes com suspeita de comprometimento metastático, bem como envolvimento de adenopatias no tronco celíaco. Sua sensibilidade é controversa, podendo variar de 38% a 90%, dependendo da série publicada.14,24,29
- –
Marcadores tumorais: estes são de utilidade limitada, sendo o CA 19,9 o mais comumente utilizado. A maioria dos estudos os avaliou em neoplasias pancreáticas e em CC em menor grau, sem especificar sua localização ou características. Os níveis no soro destes marcadores são fortemente influenciados pela obstrução biliar e icterícia devido à sua eliminação biliar. Diferentes valores normais foram propostos, dependendo da presença de hepatopatia (300U/ml) ou icterícia (1000U/ml), enquanto que no câncer pancreático são obtidas sensibilidades superiores a 70%, com níveis de especificidade superiores a 95%. A sua concentração nestes pacientes varia muito e não se correlaciona com o tamanho do tumor, embora se correlacione com o envolvimento metastático. A sensibilidade e especificidade deste marcador pode ser aumentada pela sua combinação com CEA, sobretudo em casos negativos de Lewis A (não produtores de CA 19,9).30
Pode deduzir-se dos dados acima que normalmente iniciamos o estudo usando um ultra-som para o diagnóstico de PHC. Isto ocorre no contexto de um paciente com icterícia, enquanto a tomografia computadorizada e a colangiografia de RM são os melhores testes de estadiamento e os mais recomendáveis antes da cirurgia. A RM ou a tomografia computorizada podem ser utilizadas para testes volumétricos, dependendo do tipo de aparelhos ou programas informáticos disponíveis em cada hospital. Em caso de dúvida sobre a propagação para os gânglios linfáticos, o que pode contra-indicar a tomografia por emissão de pósitrons cirúrgicos ou a endoscopia por aspiração de agulha fina é recomendada.
Critérios de não-rejeitabilidade
A cirurgia é o único tratamento curativo para a PHC, e oferece a melhor sobrevida a longo prazo. Os critérios adotados para ressecção cirúrgica se expandiram nos últimos anos, desde os descritos inicialmente pela equipe do Memorial Sloan Kettering Cancer Center de Burke et al.31, em 1998, até a recente introdução de abordagens utilizando ressecção vascular e hepatectomias prolongadas.3,5,32-34 Os critérios de não espectabilidade variam de hospital para hospital, sendo os mais difundidos: envolvimento vascular de um lado com envolvimento biliar contralateral até a divisão dos radicais de segundo nível, metástases hepáticas distantes, envolvimento vascular de ambos os lobos hepáticos, envolvimento extra-hepático ou peritoneal e envolvimento adenopático do tronco celíaco, da artéria mesentérica superior ou da região paraaórtica.3,5,8,31
Num estudo multicêntrico publicado por De Jong et al.34 que analisou 305 pacientes operados para a APS em 7 centros diferentes nos EUA e Europa, e que incluiu pacientes com envolvimento portal, em análise multivariável os 2 únicos fatores prognósticos estatisticamente significativos foram o envolvimento da margem de ressecção e o envolvimento dos gânglios linfáticos (P=,02). No estudo publicado por Ebata et al.,15 analisando 1352 pacientes operados em 8 hospitais japoneses para a APS com intenção curativa, a análise multivariável dos fatores prognósticos estatisticamente significantes mostrou que eles eram: invasão vascular, invasão do pâncreas, envolvimento dos linfonodos, presença de metástases e envolvimento da margem de ressecção. O envolvimento dos linfonodos e a metástase foram os fatores que levaram a uma sobrevida mais pobre aos 5 anos em comparação com os outros (10%, 20% e 63%, respectivamente). Estes resultados apoiam o uso da cirurgia para estes tumores, se apesar da extensão local for possível realizar uma ressecção R0, dado que é possível aumentar a sobrevida para 5 anos independentemente da extensão local.
Devido a todas as considerações acima é recomendado que cada caso seja avaliado individualmente, e que a cirurgia seja utilizada se uma ressecção R0 puder ser realizada na ausência de metástase distante ou envolvimento peritoneal. O envolvimento biliar bilateral e vascular local não deve, portanto, ser critério de não espectabilidade se for possível operar preservando mais de 30% do volume hepático e conseguir uma ressecção oncológica.
Estratégias Terapêuticas Drenagem Biliar
Dado que a maioria dos pacientes com PHC estreia com icterícia, um dos dilemas mais importantes diz respeito à utilidade da drenagem biliar pré-operatória. No entanto, esta não está livre de complicações, e as associadas à CPRE com a inserção de um stent são: pancreatite, perfuração duodenal, migração duodenal, obstrução do cateter e, o mais importante, colangite. A drenagem por CTPH apresenta uma menor frequência de colangite pré-operatória, mas está associada a hemorragia, migração do cateter, até 5% de disseminação tumoral dentro da trajetória do cateter e desconforto e dor na zona de entrada. De acordo com os estudos publicados, a CPRE tem uma morbidade associada de 60% e o valor correspondente para a HPCT é de 31%.14,35
Devido aos motivos acima, a utilidade da drenagem biliar pré-operatória em cirurgia hepatobiliopancreática tem sido posta em questão.36,37 Estes estudos, que incluem todos os tipos de cirurgia hepatobiliar, têm demonstrado que a drenagem biliar pré-operatória em pacientes com icterícia aumenta a morbidade associada sem melhorar a sobrevida, principalmente aumentando as complicações envolvendo infecções. O estudo multicêntrico europeu publicado em 2013 por Farges et al.38 analisaram retrospectivamente 366 pacientes que haviam sido submetidos a hepatectomia ou hepatectomia prolongada e ressecção biliar devido à HPC. Eles foram classificados de acordo com a realização ou não de drenagem biliar pré-operatória. O grupo sem drenagem pré-operatória (não-PBD) foi composto por 186 pacientes, e o grupo com drenagem biliar (PBD) continha 180 pacientes. Os grupos foram homogêneos em termos de idade, estágio tumoral e ressecção portal. O grupo com drenagem biliar (PBD) apresentou mais hepatectomias direitas (56% vs 44%). Quando ambos os grupos foram comparados de acordo com o tipo de cirurgia realizada, os pacientes submetidos à hepatectomia direita apresentaram maior número de insuficiência hepática pós-operatória se pertenciam ao grupo não-PBD, com incidência de 16% vs 4% no grupo PBD (P=,009). Na análise multivariável dos fatores associados com maior mortalidade no grupo de hepatectomia direita, ter níveis de bilirrubina abaixo de 3mg/dL antes da cirurgia foi um fator estatisticamente significativo. Entretanto, se comparados os dois grupos de pacientes com hepatectomia esquerda, o grupo PBD apresentou um maior número de sepse pós-operatória, com incidência de 6%, comparado a 0% no grupo não-PBD (P=.014). Este estudo mostra que, embora seja verdade que a drenagem biliar aumenta a incidência de sepse pós-operatória, a drenagem biliar deve ser realizada nos pacientes que serão submetidos à hepatectomia direita para reduzir a morbimortalidade associada à insuficiência hepática pós-operatória, e outros estudos apóiam esta teoria.39 Dado que no tratamento da HPC os únicos estudos que têm demonstrado maior sobrevida são aqueles que suportam ressecções extensas para alcançar a ressecção R0, a drenagem biliar é recomendada quando a cirurgia é indicada e pode eventualmente requerer hepatectomia extensa de mais de 50% do volume hepático ou trisegmentectomia, ou se houver colangite. Há controvérsia sobre o ponto de corte nos níveis de bilirrubina para indicar drenagem, sendo >10mg/dL uma das mais utilizadas.5,37 É recomendada a realização de drenagem biliar por CTPH, com colocação de drenagem externa, o que evita a manipulação do tumor. Isto tem menor incidência de infecções que a CPRE e possibilita, naqueles pacientes com drenagem unilateral que não normalizam seus níveis de bilirrubina, a utilização de drenagem biliar bilateral.35,40
Disseminação tumoral no local da punção tem sido descrita em até 5%-10% dos casos em que a HPCT foi utilizada,14,24 embora estes estudos não especifiquem quando foi utilizada drenagem externa ou interna-externa, e não levam em consideração o tempo decorrido até a cirurgia. Alguns autores recomendam o uso de drenagem nasobiliar endoscopicamente posicionada para evitar a disseminação no ponto de punção, com menor incidência de colangite e obstrução do stent do que no caso da CPRE.41 Entretanto, os mesmos estudos admitem a dificuldade da drenagem biliar bilateral pré-operatória utilizando este sistema, o que dificulta a normalização dos níveis de bilirrubina antes da cirurgia em pacientes nos quais a drenagem unilateral falhou.42
Para reduzir a morbidade associada às infecções após a drenagem biliar pré-operatória, sugere-se que a bílis seja sistematicamente cultivada após a drenagem e durante a cirurgia. Vários estudos têm demonstrado que 78%-94% dessas culturas são positivas para pacientes drenados, em oposição a 20%-30% para pacientes não drenados,43-45 e o enterococo é o organismo mais comumente isolado. Esses grupos defendem o uso de antibióticos profiláticos, que embora aumentem a resistência antibiótica das espécies isoladas, em estudos publicados isso se mostra para atingir uma morbidade de infecção pós-operatória semelhante à dos grupos não drenados. O antibiótico selecionado dependerá das culturas e do antibiograma, embora a maioria dos grupos tenha utilizado pelo menos uma cefalosporina de terceira geração ou fluoroquinolonas+metronidazol, quando não havia cultura disponível ou quando era negativo.43,44,46
Retirada biliar paliativa é utilizada em pacientes que não podem ser submetidos à ressecção. A drenagem pode ser por CPRE, deixando um stent metálico revestido, ou por CTPH nos casos em que é impossível alcançar a drenagem correta de ambos os ductos biliares usando CPRE.
Assim, definitivamente, a drenagem biliar pré-operatória deve ser usada em todos os pacientes com bilirrubina acima ou igual a 10mg/dL e naqueles em que a ressecção hepática será maior que 50% do volume hepático. O tipo de abordagem depende do hospital, embora a HTPH com drenagem externa seja recomendável para evitar a manipulação do tumor e a menor incidência de colangite. Alguns autores recomendam que pacientes drenados recebam antibióticos profiláticos adequados às suas culturas biliares.
Embolização portal pré-operatória
A embolização portal pré-operatória foi descrita nos anos 80, inicialmente por Makuuchi et al.47 e depois por Kinoshita et al.48 O objetivo da embolização portal é aumentar o volume hepático remanescente nos casos em que ela é considerada insuficiente na volumetria pré-operatória, reduzindo a probabilidade de insuficiência hepática pós-operatória. Numa metanálise publicada recentemente por Higuchi e Yamamoto49 que incluiu 836 pacientes com HP com embolização portal pré-operatória, a morbidade foi de 1% e a mortalidade de 0,09%. A progressão tumoral durante o procedimento que impediu a cirurgia foi de 19,4%. Estes resultados apoiam a ideia de que o seu uso na APS se justifica naqueles pacientes com um volume hepático remanescente pré-operatório inferior a 30%.
Laparoscopia em estadiamento
Com os avanços na sensibilidade e especificidade dos testes de imagem não invasivos nos últimos anos, a laparoscopia em estadiamento está caindo em desuso. Os critérios mais importantes para a não espectacularidade são o envolvimento dos gânglios linfáticos, a extensão biliar e a invasão vascular. Estes são difíceis de avaliar durante a laparoscopia, cuja precisão e eficácia têm vindo a diminuir há anos. Isto é demonstrado pela recente revisão de Rotellar e Pardo,50 na qual a precisão e a eficácia foram de 41% e 72%, respectivamente, em 2002, e de 14% e 32% em estudos publicados em 2011. Esta queda deve-se principalmente à melhoria dos testes não-invasivos, como a colangiografia por RM. Sua eficácia aumenta se forem selecionados pacientes com alto risco de apresentar disseminação peritoneal ou metástase hepática, evitando assim laparotomias desnecessárias.50-52 Técnicas de imagem não invasivas são recomendadas em estágios avançados (T2/3/4) que apresentam possível envolvimento peritoneal ou linfonodal avançado, e que não podem ser puncionadas por eco-endoscopia antes de se criar a drenagem biliar pré-operatória. Realizamos sempre a laparoscopia de estadiamento utilizando ultra-sonografia intra-operatória para melhorar a sensibilidade ao envolvimento locorregional e linfonodal.53
Tratamento Cirúrgico
A cirurgia ainda é o único tratamento curativo para a HPC,3,14 e atinge uma sobrevida de 20%-40% aos 5 anos (Tabela 2).10,11 A ressecção cirúrgica deve ser sempre realizada se for possível obter uma ressecção R0. Os principais fatores que afetam a sobrevida após a cirurgia são o envolvimento das margens de ressecção, seja microscopicamente (R1) ou macroscopicamente (R2) juntamente com o envolvimento dos linfonodos (N1 e N2).14,17,44,54 Vários estudos têm mostrado que a sobrevida aumenta se a ressecção for ampliada para criar margens negativas.3,5,33,45 As técnicas propostas incluem hepatectomias prolongadas com ressecção do segmento caudado, ressecção biliar, linfadectomia hilar até o tronco celíaco e reconstrução com hepatojejunostomia.
Survival Após a Ressecção da PHC De acordo com a Série Publicada.
| Autor | Ano | Casas | Survival a 5 anos (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20.2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Sobrevivência após ressecção hepática devido a colangiocarcinoma perihilar.
Só 2 anos de seguimento.
A técnica “no-touch” primeiramente descrita por Neuhaus et al.32 envolve a ressecção em bloco do hilo hepático sem manipulação do tumor, aumentando a sobrevida do paciente para 5 anos em mais de 15% dos casos.3,33,34,55 Esta técnica consiste basicamente na ressecção da veia porta e artéria hepática direita quando estas estão próximas ao tumor, evitando assim a sua dissecção se esta envolver manipulação do tumor, juntamente com a ressecção biliar completa com linfadenectomia ampla até a raiz do tronco celíaco e reconstrução com hepaticojejunostomia. Será preferível selecionar o lobo hepático direito (a técnica essencial “non-touch”, segundo Neuhaus)33 , na condição de que a extensão tumoral permita incluir a artéria hepática direita, que é a que está mais próxima do tumor. Este tipo de cirurgia radical leva a uma taxa aceitável de morbidade pós-operatória, de 50%-70% dependendo da série em questão, com uma mortalidade de 10%-20%.A sobrevida do paciente com PHC aos 5 anos é de 20% a 40%, enquanto estudos publicados que incluem ressecção portal e séries utilizando a técnica “no-touch” atingem 58% aos 5 anos (Fig. 2 e 3).3,5,33
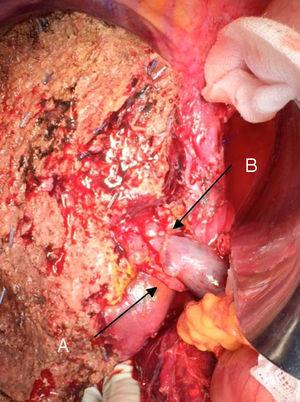
Hepatectomia esquerda para o tumor de Klatskin, com ressecção da veia porta: (A) artéria hepática direita do mesentério superior; (B) veia porta.
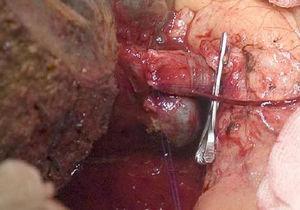
Hepatectomia direita com reconstrução da veia portal.
É também importante salientar estudos recentes que mostram um aumento na sobrevida de pacientes com envolvimento vascular pré-operatório após a ressecção portal. Chegam mesmo a atingir taxas de sobrevida iguais ou superiores às dos pacientes sem comprometimento vascular pré-operatório e que, portanto, não foram submetidos à ressecção portal.33,56,57 Nestes estudos, a incidência de complicações hepáticas e vasculares são semelhantes às do grupo sem ressecção portal, exceto para os pacientes submetidos à ressecção arterial, pois estes apresentam maior taxa de morbimortalidade do que os demais. Devido a todas essas considerações, a cirurgia é recomendada para aqueles pacientes com envolvimento unilateral portal ou envolvimento da confluência nos testes pré-operatórios, realizando uma ressecção em bloco e reconstrução vascular. A ressecção e reconstrução arterial não são recomendadas a menos que a artéria esteja claramente afetada, pois isso está associado a piores resultados pós-operatórios, de modo que, nesses casos, é preferível a hepatectomia direita.
Em resumo, os princípios cirúrgicos a serem seguidos serão: cirurgia radical com ressecção biliar e caudada e linfadenectomia, com margens de R0 e sem manipulação do tumor, ainda que isso envolva a ressecção e reconstrução da veia porta e artéria hepática.
Conclusões
Correntemente, o único tratamento curativo consiste na ressecção cirúrgica. A ressecção radical en-bloc e a reconstrução vascular é a técnica que atingiu a maior taxa de sobrevida a longo prazo. Para reduzir a morbimortalidade pós-operatória, é recomendável realizar drenagem biliar para prevenir insuficiência hepática, com profilaxia antibiótica após drenagem e embolização portal quando o volume hepático remanescente futuro for inferior a 30%. R0 ressecção, envolvimento de linfonodos e metástases distantes ainda são os fatores prognósticos mais importantes.
Conflito de Interesses
Esta revisão não foi apresentada ou publicada parcial ou totalmente em nenhuma revista ou congresso.