Introduzione
Questa neoplasia, che ha origine nell’epitelio dei dotti biliari, o colangiocarcinoma (CC), rappresenta il 10% dei tumori epatobiliari e il 2% dei tumori maligni.1,2 Il CC può essere diviso in 3 sottotipi, a seconda della loro origine anatomica all’interno del dotto biliare: CC intraepatico o periferico (ICC), CC perihilar o tumore di Klatskin (PHC) e CC distale.
PHC, che è l’oggetto di questa revisione, è il più frequente, e rappresenta circa il 40%-60% di tutti i CC.2,3 Questo tumore è aggressivo e silenzioso, con sintomi aspecifici fino agli stadi avanzati, portando a diagnosi tardiva e breve sopravvivenza senza chirurgia da 6 a 12 mesi.4 La chirurgia, che è l’unica opzione curativa disponibile, è possibile solo in circa il 47% dei pazienti al momento della diagnosi.5-8 I fattori prognostici più importanti per questo tumore sono solitamente associati alle opzioni chirurgiche, e lo stadio del tumore, le dimensioni, il coinvolgimento dei gangli e dei vascolari, le metastasi intraepatiche e il tipo istologico sono i fattori più importanti.9-11
Spazio anatomico
Lo spazio anatomico occupato dal PHC sarebbe delimitato dall’ingresso del dotto cistico a livello distale, e dalla biforcazione dei dotti epatici destro e sinistro a livello prossimale.1,12 Le classificazioni più usate includono tutti i CC che hanno origine nella confluenza biliare o nei suoi dintorni. Alcuni gruppi hanno suggerito che i CC che originano nel parenchima epatico a volte possono invadere la confluenza biliare, con un’origine nello spazio anatomico delimitato dall’origine del ramo posteriore della vena porta destra e dal legamento falciforme.13-15 Questi CC che coinvolgono la confluenza biliare sarebbero trattati allo stesso modo dei tumori con un’origine extraepatica, e la sopravvivenza è simile ai PHC nello stesso stadio. Di solito sono tumori altamente sviluppati con invasione vascolare e linfonodale locoregionale. I dubbi sul comportamento biologico di questi tumori hanno portato molti gruppi ad escluderli dai tumori perihilar. In uno studio pubblicato da Ebata et al.13,15 su 250 pazienti resecati per CC con coinvolgimento della confluenza, lo stadio e la sopravvivenza sono stati analizzati a seconda che il tumore fosse intraepatico con coinvolgimento della confluenza (ICC), o se l’origine del tumore fosse nel dotto biliare extraepatico (PHC). Un totale di 83 pazienti ha presentato ICC e 167 PHC. Quando sono stati confrontati gli stadi, i pazienti con ICC hanno mostrato una maggiore frequenza di coinvolgimento vascolare e linfonodale, con un TNM superiore a quello del gruppo PHC, presentando stadi iii e iv nel 59% dei casi, rispetto al 38% del gruppo PHC. Tuttavia, se la sopravvivenza è divisa secondo gli stadi in entrambi i gruppi, non ci sono differenze statisticamente significative a 5 anni, con una sopravvivenza globale leggermente più alta nel gruppo PHC (20% vs 29%, rispettivamente; P=.057), così che si è concluso che sono comparabili in termini di trattamento e sopravvivenza. Con il miglioramento dei test diagnostici e delle conoscenze istopatologiche, in futuro potremmo essere in grado di definire meglio se si tratta di 2 entità distinte o se sono clinicamente e biologicamente uguali.
Caratteristiche istopatologiche
Il 90% dei PHC sono adenocarcinomi. Il 10% sono carcinomi adenosquamosi o squamosi, che in alcuni casi sono stati associati ad una storia di litiasi, cisti o anomalie dei dotti biliari. Secondo l’aspetto del tumore, il tipo di crescita e il comportamento biologico e clinico dei PHC, essi sono classificati come16,17:
- –
CCTumorale o “mass-forming” CC: è la forma più comune di presentazione nell’ICC, sebbene si possa trovare anche in un gran numero di PHC. È caratterizzato dalla formazione di una massa tumorale con margini ben definiti. Ha una reazione fibrotica importante ed è frequente anche la necrosi centrale. Questo tumore ha origine nell’apertura del dotto biliare, invade la parete e si diffonde crescendo tridimensionalmente, formando una massa nodulare che dà origine a sintomi ostruttivi.16-19
- –
CC periduttale infiltrante: i tumori di questo tipo crescono lungo un dotto biliare sotto forma di un ispessimento longitudinale concentrico attraverso il tessuto connettivo intorno al dotto, causando stenosi o ostruzione completa del dotto biliare colpito.19 La maggior parte dei PHC sono di questo tipo e sono difficili da identificare con le tecniche di imaging.17
- –
CC intraduttale o papillare intraduttale: questa varietà è caratterizzata dalla presenza di tumori superficiali e intraluminali nel dotto biliare. Producono mucina e causano l’ostruzione parziale e la dilatazione dei dotti.16 Questo tumore ha un basso grado di malignità ed è solitamente di piccole dimensioni, anche se può diffondersi attraverso il muco biliare, dando origine a tumori multipli (papilomatosi o carcinomatosi papillare).20
L’importanza di questa differenziazione risiede nelle variazioni della sopravvivenza a seconda del sottotipo in questione. Diversi studi hanno dimostrato che i pazienti con il tipo papillare intraduttale hanno una prognosi migliore di quelli con la varietà sclerale-nodulare,21 con una sopravvivenza media di 55 e 33 mesi, rispettivamente,22 mentre il coinvolgimento vascolare e gangliare sono meno frequenti nel sottotipo papillare intraduttale.
Per riassumere, la maggior parte dei PHC sono adenocarcinomi con un modello di crescita periduttale che dà loro una prognosi peggiore, mentre la variante con crescita intraduttale è la meno frequente, anche se ha una prognosi migliore.
Sistemi di stadiazione
I sistemi di stadiazione dei PHC possono essere differenziati in classificazioni pre- e post-operatorie. Tra le prime, che vengono utilizzate nella pianificazione dell’intervento, il sistema più importante è la classificazione di Bismuth-Corlette. Questa indica quale lobo è colpito in modo preferenziale, e quindi indica il tipo di epatectomia da utilizzare (Fig. 1).23 Questa classificazione è stata inventata negli anni ’70 e non tiene conto né del coinvolgimento linfonodale né delle metastasi, per cui ora ha meno valore prognostico.
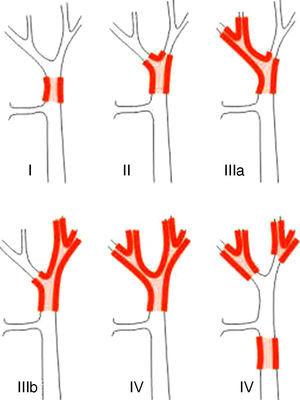
La classificazione Bismuth-Corlette23.
Un’altra classificazione preoperatoria usata negli USA è quella pubblicata da Jarnagin et al.10 del Memorial Sloan Kettering Cancer Centre, New York. Questa classificazione mira a predire la resecabilità dei tumori, prendendo in considerazione 3 fattori di estensione locale. Questi sono l’estensione biliare, il coinvolgimento vascolare e l’atrofia del lobo. Questa classificazione non prende in considerazione né il coinvolgimento linfonodale né le metastasi, per cui ha meno valore prognostico. Poiché la resecabilità è diversa da gruppo a gruppo, mentre la tendenza è verso trattamenti sempre più aggressivi, il suo valore dipenderà dai criteri di non resecabilità di ogni centro. Il coinvolgimento locale non dovrebbe ora essere un criterio di non resecabilità, a condizione che siamo in grado di ottenere un R0 con la resezione chirurgica.
Tra le classificazioni postoperatorie, la più utilizzata è la classificazione TNM della Union for International Cancer Control (UICC), settima edizione.12 Questa classificazione prende in considerazione i dati patologici, come l’estensione locale, il coinvolgimento vascolare, il coinvolgimento linfonodale e le metastasi, per stabilire una classificazione che include l’estensione del tumore ed è di natura prognostica.
Di recente il “Japanese Study Group on Perihilar Cholangiocarcinoma” (JSGPH) ha pubblicato uno studio che propone di modificare la classificazione della “Union for International Cancer Control”. Le differenze fondamentali sono riportate nella tabella 1, e consistono principalmente in13:
-
Non considerare il Bismuto IV come T4. La classificazione del JSGPH quindi non considera l’estensione bilaterale biliare come una prognosi sfavorevole se si ottiene una resezione R0.
-
Per quanto riguarda gli stadi, dà la priorità al coinvolgimento linfonodale come prognosi peggiore. Considerano quindi il coinvolgimento linfonodale come stadio iva e non iiib (TNM7).
Confronto delle differenze fondamentali tra la classificazione UICC TNM 7 e la proposta del JSGPH.
| Classificazione dei tumori | UICC | Proposta JSGPH |
|---|---|---|
| Tis | Carcinoma in situ | |
| T1 | Tumore confinato al dotto biliare | |
| T2a | Supera la parete del dotto e invade il tessuto adiposo perilesionale | |
| T2b | Invade il parenchima epatico | |
| T3 | Invasione unilaterale dell’arteria/vena epatica | |
| T4 | Invasione del ramo principale dell’HA/PV, Bismuto IV, o Bismuth III con invasione controlaterale dell’A/V | Invasione vascolare della marca principale dell’HA/PV, con invasione vascolare bilaterale o controlaterale |
| stadio TNM | ||
| 0 | Tis N0 M0 | |
| I | T1 N0 M0 | |
| II | T2 N0 M0 | |
| IIIa | T3 N0 M0 | |
| IIIb | T1-3 N1 M0 | T4 N0 M0 |
| Iva | T4 N× M0 | T× N1 M0 |
| Ivb | T× N× M1 | |
HA, arteria epatica; JSGPH, Japanese Study Group on Perihilar Cholangiocarcinoma; TNM, tumour lymph node metastasis; UICC, Union for International Cancer Control; PV, portal vein.
A livello europeo è stato creato un registro internazionale dei tumori perilari trattati chirurgicamente, guidato dall'”International Cholangiocarcinoma Group for the Staging of PHC”. Questo gruppo ha pubblicato una nuova classificazione1 che prende in considerazione le dimensioni del tumore, insieme al coinvolgimento biliare, venoso, arterioso, gangliare e metastatico, sia pre che post operatorio. Tuttavia, le restrizioni di questa classificazione consistono nel fatto che si limita a descrivere le caratteristiche del tumore e l’intervento chirurgico da eseguire, senza continuare a dividere i pazienti in gruppi o stadi in base a queste variabili. Di conseguenza, non è possibile trarre conclusioni prognostiche ed è anche impossibile confrontare i risultati dei diversi gruppi.
Precedenti pubblicazioni mostrano che la classificazione preoperatoria più utilizzata attualmente per decidere il tipo di resezione è quella di Bismuth-Corlette, mentre la classificazione TNM 7 è utilizzata per definire la prognosi a lungo termine.
Strategie diagnostiche
I sintomi associati più frequentemente al PHC sono: ittero (90%), perdita di peso e dolore addominale (35%), prurito (26%) e colangite acuta (10%).17 A causa di questi sintomi la diagnosi iniziale viene solitamente fatta utilizzando l’ecografia addominale, e questo è un buon test di screening. Altri test diagnostici per questo tipo di tumore sarebbero:
- –
Ultrasuono Doppler addominale: questo permette di valutare la permeabilità arteriosa e portale (trombosi), che può condizionare la resecabilità del tumore e la strategia terapeutica, sebbene non sia il test di scelta per la valutazione del coinvolgimento vascolare.
- –
Tomografia assiale computerizzata addominale: è utile per la diagnosi del tumore primario e dell’estensione della malattia, con una sensibilità dell’80% nella valutazione dell’estensione biliare. È la tecnica di scelta per la valutazione preoperatoria dell’anatomia vascolare, con una sensibilità del 93% e dell’87% per la valutazione del coinvolgimento arterioso e portale, rispettivamente. Ha una bassa sensibilità per la valutazione preoperatoria del coinvolgimento linfonodale (50%).14,24 È anche utile per eseguire test volumetrici e calcolare il volume epatico rimanente dopo la resezione chirurgica. È anche il test più economico per la stadiazione preoperatoria.
- –
Risonanza magnetica e colangiografia a risonanza magnetica (RM-colangiografia): il miglior test per la diagnosi del tumore primario e per valutare l’estensione biliare. Ha una sensibilità dell’86%-100%, ed è migliore della colangiografia diretta, mentre è anche un test non invasivo.25 D’altra parte, ha una bassa sensibilità per la valutazione del coinvolgimento vascolare (73%) e una sensibilità dell’80% per l’invasione del parenchima epatico.
- –
Colangiografia diretta: colangiopancreatografia retrograda endoscopica (ERCP) e colangiografia epatica transparietale (TPHC): ci informano sul livello di ostruzione biliare e permettono di prelevare campioni dalla lesione per la citologia, con una sensibilità del 20%. Ora sono state sostituite nella diagnosi dalla colangiografia MR. Sono molto utili per il drenaggio biliare preoperatorio e nel trattamento palliativo della PHC, con l’inserimento di stent preferibilmente rivestiti di metallo.26-28
- –
Esame endoscopico: è utile per la valutazione dell’interessamento dei gangli nella zona del tronco celiaco e della regione peripancreatica, per stabilire la stadiazione preoperatoria e per rendere possibile l’esecuzione di biopsie con ago aspirato fine.
- –
Tomografia a emissione di positroni: è utile nello studio dei pazienti con sospetto di coinvolgimento metastatico così come il coinvolgimento delle adenopatie nel tronco celiaco. La sua sensibilità è controversa, e può variare dal 38% al 90%, a seconda delle serie pubblicate.14,24,29
- –
Marcatori tumorali: sono di utilità limitata, e il CA 19.9 è il più usato. La maggior parte degli studi li ha valutati nelle neoplasie pancreatiche e, in misura minore, nel CC, senza specificarne la sede o le caratteristiche. I livelli nel siero di questi marcatori sono fortemente influenzati dall’ostruzione biliare e dall’ittero a causa della loro eliminazione biliare. Sono stati proposti diversi valori normali, a seconda della presenza di epatopatia (300U/ml) o di ittero (1000U/ml), mentre nel cancro pancreatico si ottengono sensibilità superiori al 70%, con livelli di specificità superiori al 95%. La sua concentrazione in questi pazienti varia ampiamente e non è correlata alle dimensioni del tumore, sebbene sia correlata al coinvolgimento metastatico. La sensibilità e la specificità di questo marcatore possono essere aumentate combinandolo con il CEA, soprattutto nei casi Lewis A negativi (non produttori di CA 19,9).30
Si può dedurre dai dati di cui sopra che di solito si inizia lo studio con un’ecografia per la diagnosi di PHC. Questo avviene nel contesto di un paziente con ittero, mentre la tomografia computerizzata e la MR-colangiografia sono i migliori test di stadiazione e i più raccomandabili prima di un intervento chirurgico. La risonanza magnetica o la tomografia computerizzata possono essere utilizzate per l’esame volumetrico, a seconda del tipo di apparecchiatura o di programmi informatici disponibili in ogni ospedale. Se c’è un dubbio sulla diffusione nei linfonodi che può controindicare l’intervento chirurgico, si raccomanda la tomografia a emissione di positroni o l’endoscopia con ago aspirato sottile.
Criteri di non resecabilità
La chirurgia è l’unico trattamento curativo per la PHC, e offre la migliore sopravvivenza a lungo termine. I criteri adottati per la resezione chirurgica si sono ampliati negli ultimi anni, da quelli descritti inizialmente dal team del Memorial Sloan Kettering Cancer Center di Burke et al.31 nel 1998, fino alla recente introduzione di approcci che utilizzano la resezione vascolare e le epatectomie estese.3,5,32-34 I criteri di non resecabilità variano da ospedale a ospedale, e i più diffusi sono: coinvolgimento vascolare su un lato con coinvolgimento biliare controlaterale fino alla divisione dei radicali di secondo livello, metastasi epatiche a distanza, coinvolgimento vascolare di entrambi i lobi epatici, coinvolgimento extraepatico o peritoneale e coinvolgimento adenopatico del tronco celiaco, dell’arteria mesenterica superiore o della regione paraaortica.3,5,8,31
In uno studio multicentrico pubblicato da De Jong et al.34 che ha analizzato 305 pazienti operati per PHC in 7 diversi centri negli USA e in Europa, e che includeva pazienti con coinvolgimento portale, nell’analisi multivariabile gli unici 2 fattori prognostici statisticamente significativi erano il coinvolgimento del margine di resezione e il coinvolgimento linfonodale (P=.02). Nello studio pubblicato da Ebata et al.15 , che ha analizzato 1352 pazienti operati in 8 ospedali giapponesi per PHC con intento curativo, l’analisi multivariabile dei fattori prognostici statisticamente significativi ha mostrato che essi sono: invasione vascolare, invasione del pancreas, coinvolgimento linfonodale, presenza di metastasi e coinvolgimento del margine di resezione. Il coinvolgimento linfonodale e le metastasi erano i fattori che portavano a una sopravvivenza più povera a 5 anni rispetto agli altri (10%, 20% e 63%, rispettivamente). Questi risultati supportano l’uso della chirurgia per questi tumori, se nonostante l’estensione locale è possibile eseguire una resezione R0, dato che è possibile aumentare la sopravvivenza a 5 anni indipendentemente dall’estensione locale.
A causa di tutte le considerazioni di cui sopra, si raccomanda di valutare ogni caso individualmente e di ricorrere alla chirurgia se è possibile ottenere una resezione R0 in assenza di metastasi a distanza o coinvolgimento peritoneale. Il coinvolgimento bilaterale delle vie biliari e vascolare locale non dovrebbe quindi essere un criterio di non resecabilità se è possibile operare conservando più del 30% del volume del fegato e ottenendo una resezione oncologica.
Strategie terapeuticheDrenaggio biliare
Dato che la maggior parte dei pazienti con PHC esordisce con ittero, uno dei dilemmi più importanti riguarda l’utilità del drenaggio biliare preoperatorio. Tuttavia, questo non è esente da complicazioni, e quelle associate alla ERCP con inserimento di uno stent sono: pancreatite, perforazione duodenale, migrazione duodenale, ostruzione del catetere e, soprattutto, colangite. Il drenaggio mediante CTPH presenta una minore frequenza di colangite preoperatoria, ma è associato a emorragia, migrazione del catetere, fino al 5% di diffusione del tumore nella traiettoria del catetere e disagio e dolore nella zona di ingresso. Complessivamente, secondo gli studi pubblicati, la ERCP ha una morbilità associata del 60%, e la cifra corrispondente per la CTPH è del 31%.14,35
A causa delle ragioni di cui sopra, l’utilità del drenaggio biliare preoperatorio nella chirurgia epatobiliopancreatica è stata messa in discussione.36,37 Questi studi, che comprendono tutti i tipi di chirurgia epatobiliare, hanno dimostrato che il drenaggio biliare preoperatorio nei pazienti con ittero aumenta la morbilità associata senza migliorare la sopravvivenza, aumentando principalmente le complicazioni legate alle infezioni. Lo studio multicentrico europeo pubblicato nel 2013 da Farges et al.38 ha analizzato retrospettivamente 366 pazienti sottoposti a epatectomia o epatectomia estesa e resezione biliare per PHC. Sono stati classificati in base all’esecuzione o meno di un drenaggio biliare preoperatorio. Il gruppo senza drenaggio preoperatorio (non-PBD) era composto da 186 pazienti, e il gruppo con drenaggio biliare (PBD) conteneva 180 pazienti. I gruppi erano omogenei in termini di età, stadio del tumore e resezione portale. Il gruppo PBD presentava più epatectomie destre (56% vs 44%). Quando i due gruppi sono stati confrontati in base al tipo di intervento chirurgico eseguito, i pazienti sottoposti a epatectomia destra hanno mostrato un numero maggiore di insufficienza epatica postoperatoria se appartenevano al gruppo non-PBD, con un’incidenza del 16% vs 4% nel gruppo PBD (P=.009). Nell’analisi multivariabile dei fattori associati a una maggiore mortalità nel gruppo dell’epatectomia destra, avere livelli di bilirubina inferiori a 3mg/dL prima dell’intervento era un fattore statisticamente significativo. Tuttavia, se entrambi i gruppi di pazienti con epatectomia sinistra sono stati confrontati, il gruppo PBD ha presentato un numero maggiore di sepsi postoperatorie, con un’incidenza del 6%, rispetto allo 0% nel gruppo non-PBD (P=.014). Questo studio dimostra che anche se è vero che il drenaggio biliare aumenta l’incidenza della sepsi postoperatoria, il drenaggio biliare dovrebbe essere eseguito in quei pazienti che stanno per essere sottoposti a epatectomia destra per ridurre la morbilità associata all’insufficienza epatica postoperatoria, e altri studi sostengono questa teoria.39 Dato che nel trattamento della PHC gli unici studi che hanno dimostrato una maggiore sopravvivenza sono quelli che sostengono resezioni estese per ottenere una resezione R0, il drenaggio biliare è raccomandato quando l’intervento è indicato, e può eventualmente richiedere un’epatectomia estesa di più del 50% del volume epatico o una trisegmentectomia, o se c’è colangite. C’è controversia sul punto di cut-off dei livelli di bilirubina per indicare il drenaggio, e >10mg/dL è uno dei più usati.5,37 Si raccomanda di eseguire il drenaggio biliare mediante CTPH, con posizionamento del drenaggio esterno, che evita la manipolazione del tumore. Questo ha una minore incidenza di infezioni rispetto al CPRE e rende possibile, in quei pazienti con drenaggio unilaterale che non normalizzano i loro livelli di bilirubina, utilizzare il drenaggio biliare biliare.35,40
La disseminazione del tumore nel sito di puntura è stata descritta fino al 5%-10% dei casi in cui è stata utilizzata la CTPH,14,24 anche se questi studi non specificano quando è stato utilizzato il drenaggio esterno o interno-esterno, e non tengono conto del tempo trascorso fino all’intervento. Alcuni autori raccomandano l’uso di un drenaggio nasale posizionato endoscopicamente per prevenire la disseminazione nel punto di puntura, con una minore incidenza di colangite e ostruzione dello stent rispetto a quanto avviene con la CPRE.41 Tuttavia, gli stessi studi ammettono la difficoltà del drenaggio bilaterale preoperatorio con questo sistema, e ciò ostacola la normalizzazione dei livelli di bilirubina prima dell’intervento chirurgico nei pazienti in cui il drenaggio unilaterale è fallito.42
Per ridurre la morbilità associata alle infezioni dopo il drenaggio biliare preoperatorio, si suggerisce che la bile venga sistematicamente messa in coltura dopo il drenaggio e durante l’intervento. Diversi studi hanno dimostrato che il 78%-94% di queste colture sono positive per i pazienti drenati, rispetto al 20%-30% per i pazienti non drenati,43-45 e l’enterococco è l’organismo più comunemente isolato. Questi gruppi difendono l’uso di antibiotici profilattici, che anche se aumentano la resistenza agli antibiotici delle specie isolate, in studi pubblicati è dimostrato che si ottiene una morbilità di infezione postoperatoria simile a quella dei gruppi non drenati. L’antibiotico selezionato dipenderà dalle colture e dall’antibiogramma, anche se la maggior parte dei gruppi ha utilizzato almeno una cefalosporina di terza generazione o fluorochinoloni+metronidazolo, quando non era disponibile alcuna coltura o quando questa era negativa.43,44,46
Il drenaggio biliare palliativo viene utilizzato nei pazienti che non possono essere sottoposti a resezione. Il drenaggio può avvenire tramite ERCP, lasciando uno stent metallico rivestito, o tramite CTPH in quei casi in cui è impossibile ottenere un drenaggio corretto di entrambi i dotti biliari usando l’ERCP.
Quindi, definitivamente, il drenaggio biliare preoperatorio dovrebbe essere usato in tutti i pazienti con bilirubina superiore o uguale a 10mg/dL e in quelli in cui le resezioni epatiche saranno superiori al 50% del volume epatico. Il tipo di approccio dipende dall’ospedale, anche se il CTPH con drenaggio esterno è raccomandabile per evitare la manipolazione del tumore e la minore incidenza di colangite. Alcuni autori raccomandano che i pazienti drenati ricevano antibiotici profilattici adatti alle loro colture biliari.
Embolizzazione portale preoperatoria
L’embolizzazione portale preoperatoria è stata descritta negli anni ’80, inizialmente da Makuuchi et al.47 e poi da Kinoshita et al.48 Lo scopo dell’embolizzazione portale è di aumentare il volume epatico rimanente in quei casi in cui è considerato insufficiente nella volumetria preoperatoria, riducendo la probabilità di insufficienza epatica postoperatoria. In una meta-analisi pubblicata recentemente da Higuchi e Yamamoto49 che includeva 836 pazienti con PHC con embolizzazione portale preoperatoria, la morbilità era dell’1% e la mortalità dello 0,09%. La progressione del tumore durante la procedura che ha impedito l’intervento è stata del 19,4%. Questi risultati supportano l’idea che il suo uso nella PHC è giustificato in quei pazienti con un volume epatico residuo preoperatorio inferiore al 30%.
Laparoscopia di stadiazione
Con i progressi nella sensibilità e specificità dei test di imaging non invasivo negli ultimi anni, la laparoscopia di stadiazione sta cadendo in disuso. I criteri più importanti per la non resecabilità sono il coinvolgimento linfonodale, l’estensione biliare e l’invasione vascolare. Questi sono difficili da valutare durante la laparoscopia, la cui precisione ed efficacia sono in calo da anni. Lo dimostra la recente revisione di Rotellar e Pardo50 , in cui la precisione e l’efficacia erano rispettivamente del 41% e del 72% nel 2002, e del 14% e del 32% negli studi pubblicati nel 2011. Questo calo è dovuto principalmente al miglioramento dei test non invasivi come la colangiografia RM. La sua efficacia aumenta se si selezionano pazienti ad alto rischio di presentare una disseminazione peritoneale o metastasi epatiche, evitando così laparotomie inutili.50-52 Le tecniche di imaging non invasive sono raccomandate negli stadi avanzati (T2/3/4) che presentano un possibile coinvolgimento peritoneale o linfonodale avanzato, e che non possono essere perforati con l’eco-endoscopia prima di creare il drenaggio biliare preoperatorio. Eseguiamo sempre la laparoscopia di stadiazione utilizzando l’ecografia intraoperatoria per migliorare la sensibilità al coinvolgimento locoregionale e linfonodale.53
Trattamento chirurgico
La chirurgia è ancora l’unico trattamento curativo per la PHC,3,14 e raggiunge un tasso di sopravvivenza del 20%-40% a 5 anni (Tabella 2).10,11 La resezione chirurgica deve essere sempre eseguita se è possibile ottenere una resezione R0. I principali fattori che influenzano la sopravvivenza dopo l’intervento chirurgico sono il coinvolgimento dei margini di resezione, sia microscopicamente (R1) che macroscopicamente (R2) insieme al coinvolgimento linfonodale (N1 e N2).14,17,44,54 Diversi studi hanno dimostrato che la sopravvivenza aumenta se la resezione viene ampliata per creare margini negativi.3,5,33,45 Le tecniche proposte includono epatectomie estese con resezione del segmento caudato, resezione biliare, linfoadectomia ilare fino al tronco celiaco e ricostruzione con epatogiunostomia.
Sopravvivenza dopo resezione del PHC secondo la serie pubblicata.
| Autore | Anno | Casi | Vita a 5 anni (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20.2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Sopravvivenza dopo resezione epatica dovuta a colangiocarcinoma perihilar.
Solo 2 anni di follow-up.
La “tecnica no-touch” descritta per la prima volta da Neuhaus et al.32 comporta la resezione in blocco dell’ilo epatico senza manipolazione del tumore, aumentando la sopravvivenza del paziente a 5 anni in più del 15% dei casi.3,33,34,55 Questa tecnica consiste fondamentalmente nella resezione della vena porta e dell’arteria epatica destra quando sono vicine al tumore, evitando così la sua dissezione se questa comporta la manipolazione del tumore, insieme alla resezione biliare completa con ampia linfoadenectomia fino alla radice del tronco celiaco e ricostruzione con epatico-giunostomia. Sarà preferibile selezionare il lobo epatico destro (la fondamentale “tecnica del non tocco”, secondo Neuhaus),33 a condizione che l’estensione del tumore permetta di includere l’arteria epatica destra, che è quella più vicina al tumore. Questo tipo di chirurgia radicale porta ad un tasso accettabile di morbilità postoperatoria, del 50%-70% a seconda della serie in questione, con una mortalità del 10%-20%.3,5 La sopravvivenza dei pazienti PHC a 5 anni si attesta tra il 20% e il 40%, mentre gli studi pubblicati che includono la resezione portale e le serie che utilizzano la “no-touch technique” raggiungono il 58% a 5 anni (Figg. 2 e 3).3,5,33
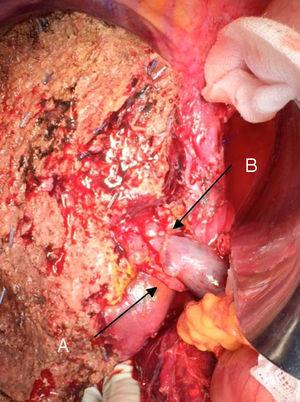
Epatectomia sinistra per il tumore di Klatskin, con resezione della vena porta: (A) arteria epatica destra del mesenterio superiore; (B) vena porta.
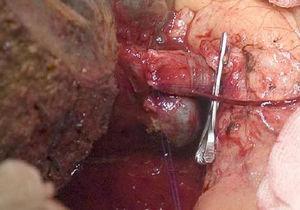
Epatectomia destra con ricostruzione della vena porta.
È anche importante sottolineare gli studi recenti che mostrano un aumento della sopravvivenza dei pazienti con coinvolgimento vascolare preoperatorio dopo resezione portale. Essi raggiungono addirittura tassi di sopravvivenza uguali o superiori a quelli dei pazienti senza coinvolgimento vascolare preoperatorio e che quindi non sono stati sottoposti a resezione portale.33,56,57 In questi studi, l’incidenza delle complicazioni epatiche e vascolari sono simili a quelle del gruppo senza resezione portale, ad eccezione dei pazienti sottoposti a resezione arteriosa, poiché questi presentano un tasso di morbilità più elevato degli altri. A causa di tutte queste considerazioni, si raccomanda l’intervento chirurgico per quei pazienti con coinvolgimento portale unilaterale o coinvolgimento della confluenza nei test preoperatori, eseguendo una resezione in blocco e ricostruzione vascolare. La resezione arteriosa e la ricostruzione non sono raccomandate a meno che l’arteria non sia chiaramente interessata, in quanto ciò è associato a esiti postoperatori più scadenti, per cui in tali casi è preferibile l’epatectomia destra.
Per riassumere, i principi chirurgici da seguire saranno: chirurgia radicale con resezione biliare e caudata e linfoadenectomia, con margini R0 e senza manipolazione del tumore, anche se questo comporta la resezione e la ricostruzione della vena porta e dell’arteria epatica.
Conclusioni
Oggi, l’unico trattamento curativo consiste nella resezione chirurgica. La resezione radicale in blocco e la ricostruzione vascolare è la tecnica che ha raggiunto il più alto tasso di sopravvivenza a lungo termine. Per ridurre la morbosità postoperatoria, è consigliabile eseguire un drenaggio biliare per prevenire l’insufficienza epatica, con profilassi antibiotica dopo il drenaggio ed embolizzazione portale quando il futuro volume epatico residuo sarà inferiore al 30%. La resezione R0, il coinvolgimento linfonodale e le metastasi a distanza sono ancora i fattori prognostici più importanti.
Conflitto di interessi
Questa revisione non è stata presentata o pubblicata parzialmente o interamente in nessuna rivista o congresso.