Comunicato stampa
Lunedì 28 dicembre 2020
La sperimentazione finanziata da NIH e BARDA arruolerà fino a 30.000 volontari.
Le persone di 18 anni e più che sono interessate a partecipare a questo studio possono visitare coronaviruspreventionnetwork.org, ClinicalTrials.gov e cercare l’identificatore NCT04611802, o Novavax.com/PREVENT-19 per i dettagli. Si prega di non contattare il numero di telefono o l’e-mail del NIAID per iscriversi a questo trial.
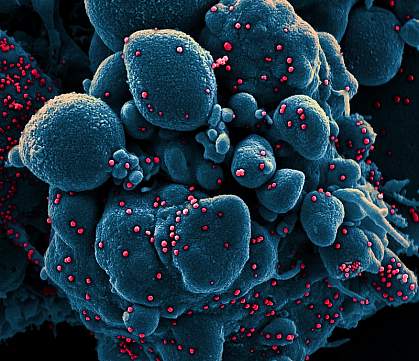 Micrografia elettronica a scansione colorata di una cellula apoptotica (blu) infettata da particelle di virus SARS-COV-2 (rosso), isolate da un campione di paziente.NIAID
Micrografia elettronica a scansione colorata di una cellula apoptotica (blu) infettata da particelle di virus SARS-COV-2 (rosso), isolate da un campione di paziente.NIAID La sperimentazione di fase 3 di un altro vaccino sperimentale contro il coronavirus 2019 (COVID-19) ha iniziato ad arruolare volontari adulti. Lo studio randomizzato e controllato con placebo arruolerà circa 30.000 persone in circa 115 siti negli Stati Uniti e in Messico. Valuterà la sicurezza e l’efficacia di NVX-CoV2373, un candidato vaccino sviluppato da Novavax, Inc. di Gaithersburg, Maryland. Novavax sta conducendo la sperimentazione come sponsor normativo. Il National Institute of Allergy and Infectious Diseases (NIAID), parte del National Institutes of Health, e la Biomedical Advanced Research and Development Authority (BARDA), parte del U.S. Department of Health and Human Services Office of the Assistant Secretary for Preparedness and Response, stanno finanziando la sperimentazione.
“Affrontare la crisi sanitaria senza precedenti del COVID-19 ha richiesto sforzi straordinari da parte di governo, università, industria e comunità,” ha detto il direttore del NIAID Anthony S. Fauci, M.D. “Il lancio di questo studio – il quinto candidato vaccino sperimentale COVID-19 ad essere testato in un trial di fase 3 negli Stati Uniti – dimostra la nostra determinazione a porre fine alla pandemia attraverso lo sviluppo di più vaccini sicuri ed efficaci.”
Il trial è condotto in collaborazione con Operation Warp Speed (OWS), una collaborazione multi-agenzia supervisionata da HHS e Dipartimento della Difesa che mira ad accelerare lo sviluppo, la produzione e la distribuzione di contromisure mediche per COVID-19. Alcuni dei siti di sperimentazione statunitensi che partecipano fanno parte della rete di prevenzione COVID-19 supportata dal NIAID (CoVPN). Il CoVPN include le reti di ricerca clinica esistenti sostenute dal NIAID con esperienza nelle malattie infettive ed è stato progettato per una valutazione rapida e approfondita dei candidati vaccini e degli anticorpi monoclonali per prevenire COVID-19.
Ai volontari verrà chiesto di dare il consenso informato prima della loro partecipazione alla sperimentazione. Saranno raggruppati in due coorti: individui da 18 a 64 anni e quelli di età pari o superiore a 65 anni, con l’obiettivo di arruolare almeno il 25% di tutti i volontari che hanno 65 anni o più. Gli organizzatori di prova anche stanno sottolineando il reclutamento di persone che sono a più alto rischio di grave malattia COVID-19, compresi coloro che sono neri (compresi gli afroamericani), nativi americani, o di etnia latina o ispanica, e le persone che hanno condizioni di salute sottostante come l’obesità, malattia renale cronica o diabete.
“Siamo arrivati a questo punto, questo veloce, ma abbiamo bisogno di arrivare al traguardo,” ha detto NIH direttore Francis S. Collins, M.D., Ph.D. “Che richiederà più vaccini utilizzando diversi approcci per garantire che tutti siano protetti in modo sicuro ed efficace da questa malattia mortale.”
Dopo aver fornito un campione nasofaringeo e di sangue di base, i partecipanti saranno assegnati a caso per ricevere un’iniezione intramuscolare del vaccino sperimentale o un placebo salino. La randomizzazione sarà in un rapporto 2:1 con due volontari che ricevono il vaccino sperimentale per ognuno che riceve il placebo. Poiché lo studio è in cieco, né gli investigatori né i partecipanti sapranno chi sta ricevendo il vaccino candidato. Una seconda iniezione sarà somministrata 21 giorni dopo la prima.
I partecipanti saranno seguiti da vicino per i potenziali effetti collaterali del vaccino e sarà chiesto di fornire campioni di sangue in momenti specifici dopo ogni iniezione e durante i due anni successivi. Gli scienziati analizzeranno i campioni di sangue per rilevare e quantificare le risposte immunitarie alla SARS-CoV-2, il virus che causa la COVID-19. Da notare che verranno utilizzati saggi specializzati per distinguere tra l’immunità come risultato dell’infezione naturale e l’immunità indotta dal vaccino. L’endpoint primario della sperimentazione è quello di determinare se NVX-CoV2373 può prevenire la malattia sintomatica COVID-19 sette o più giorni dopo la seconda iniezione rispetto al placebo.
Il vaccino sperimentale di Novavax, NVX-CoV2373, è fatto da una forma stabilizzata della proteina spike del coronavirus utilizzando la tecnologia delle nanoparticelle di proteine ricombinanti della società. Gli antigeni proteici purificati nel vaccino non possono replicarsi e non possono causare COVID-19. Il vaccino contiene anche un adiuvante proprietario, MatrixM™. Gli adiuvanti sono additivi che migliorano le risposte del sistema immunitario al vaccino. NVX-CoV2373 viene somministrato in forma liquida e può essere conservato, manipolato e distribuito a temperature superiori al congelamento (da 35° a 46°F). Una singola dose di vaccino contiene 5 microgrammi (mcg) di proteina e 50 mcg di adiuvante.
Nei test sugli animali, la vaccinazione NVX-CoV2373 ha prodotto anticorpi che hanno bloccato la proteina spike del coronavirus dal legarsi ai recettori della superficie cellulare presi di mira dal virus, impedendo l’infezione virale. Nei risultati di uno studio clinico di fase 1 pubblicato sul New England Journal of Medicine, NVX-CoV2373 è stato generalmente ben tollerato e ha suscitato livelli più elevati di anticorpi rispetto a quelli visti nei campioni di sangue prelevati da persone che avevano recuperato da COVID-19 clinicamente significativo. NVX-CoV2373 è anche in fase di valutazione in uno studio di fase 2b in Sud Africa, ora completamente arruolato con 4.422 volontari, e i dati da uno studio di prosecuzione di fase 1/2 negli Stati Uniti e in Australia sono attesi già nel primo trimestre 2021. Novavax ha anche recentemente completato l’arruolamento di più di 15.000 volontari in uno studio di Fase 3 del candidato vaccino nel Regno Unito, che sta anche testando due iniezioni di 5 mcg di proteina e 50 mcg di adiuvante Matrix-M somministrati a distanza di 21 giorni.
Un Data and Safety Monitoring Board (DSMB) indipendente fornirà la supervisione per garantire lo svolgimento sicuro ed etico dello studio. Tutti gli studi clinici di fase 3 dei vaccini candidati sostenuti attraverso OWS sono supervisionati da un DSMB comune sviluppato in consultazione con l’iniziativa NIH Accelerating COVID-19 Therapeutic Interventions and Vaccines (ACTIV).
Gli adulti che sono interessati a partecipare a questo studio possono visitare Coronaviruspreventionnetwork.org, Novavax.com/PREVENT-19 o ClinicalTrials.gov e cercare l’identificatore NCT04611802.
Sul COVID-19 Prevention Network: Il COVID-19 Prevention Network (CoVPN) è stato formato dal National Institute of Allergy and Infectious Diseases (NIAID) presso gli US National Institutes of Health per rispondere alla pandemia globale. Attraverso il CoVPN, il NIAID sta sfruttando l’esperienza nelle malattie infettive delle sue reti di ricerca esistenti e dei partner globali per affrontare il bisogno urgente di vaccini e anticorpi contro la SARS-CoV-2. Il CoVPN lavorerà per sviluppare e condurre studi per garantire una valutazione rapida e approfondita dei vaccini e degli anticorpi per la prevenzione della COVID-19. Il CoVPN ha sede presso il Fred Hutchinson Cancer Research Center. Per maggiori informazioni sulla CoVPN, visita: coronaviruspreventionnetwork.org.
Su HHS, ASPR e BARDA: HHS lavora per migliorare e proteggere la salute e il benessere di tutti gli americani, fornendo servizi sanitari e umani efficaci e promuovendo i progressi nella medicina, nella salute pubblica e nei servizi sociali. La missione dell’ASPR è salvare vite e proteggere gli americani dalle minacce alla sicurezza sanitaria del 21° secolo. All’interno dell’ASPR, BARDA investe in innovazione, ricerca avanzata e sviluppo, acquisizione e produzione di contromisure mediche – vaccini, farmaci, terapie, strumenti diagnostici e prodotti non farmaceutici necessari per combattere le minacce alla sicurezza sanitaria. Ad oggi, i prodotti sostenuti dalla BARDA hanno ottenuto 55 approvazioni, licenze o autorizzazioni della FDA. Per saperne di più sul supporto federale per la risposta nazionale COVID-19, visitare www.coronavirus.gov.
Sul funzionamento Warp Speed: OWS è una partnership tra i componenti del Dipartimento della Salute e dei Servizi Umani e il Dipartimento della Difesa, impegnandosi con aziende private e altre agenzie federali, e coordinando tra gli sforzi esistenti HHS-wide per accelerare lo sviluppo, la produzione e la distribuzione di vaccini COVID-19, terapeutici e diagnostici.
Sul National Institute of Allergy and Infectious Diseases: NIAID conduce e sostiene la ricerca – al NIH, in tutti gli Stati Uniti e in tutto il mondo – per studiare le cause delle malattie infettive e immunomediate, e per sviluppare mezzi migliori per prevenire, diagnosticare e trattare queste malattie. Comunicati stampa, fogli informativi e altri materiali relativi al NIAID sono disponibili sul sito web del NIAID.
Sul National Institutes of Health (NIH):NIH, l’agenzia di ricerca medica della nazione, comprende 27 istituti e centri ed è una componente del Dipartimento della salute e dei servizi umani degli Stati Uniti. NIH è la principale agenzia federale che conduce e sostiene la ricerca medica di base, clinica e traslazionale, e studia le cause, i trattamenti e le cure per le malattie comuni e rare. Per maggiori informazioni su NIH e i suoi programmi, visita www.nih.gov.
NIH…Turning Discovery Into Health®
###