US Pharm. 2017;42(4):HS16-HS20.
ABSTRACT: Le infezioni necrotizzanti dei tessuti molli (NSTI) sono un tipo di infezione batterica grave che richiede un rapido riconoscimento e intervento da parte di medici e chirurghi in combinazione con un trattamento antibiotico tempestivo. Queste infezioni possono avere una causa polimicrobica, ma lo Staphylococcus aureus meticillino-resistente è coinvolto nella maggior parte dei casi. Nel trattamento delle NSTI, il tempo è fondamentale per evitare complicazioni come l’amputazione, e nuovi farmaci sono stati recentemente aggiunti alla lista delle opzioni di trattamento. Questi nuovi antibiotici includono tedizolid (Sivextro), oritavancin (Orbactiv) e dalbavancin (Dalvance). In particolare, la lunga emivita della dalbavancina e dell’oritavancina consente un regime a dose singola o un dosaggio monosettimanale.
L’infezione necrotizzante dei tessuti molli (NSTI) è un termine più ampio della fascite necrotizzante perché, nella NSTI, l’infezione può estendersi oltre la fascia. I termini colloquiali includono “batteri mangia-carne” e “infezione mangia-carne”. Questo tipo di infezione fu notato per la prima volta nel V secolo a.C. da Ippocrate, che lo descrisse come segue: “Molti venivano attaccati dall’erisipela in tutto il corpo quando la causa eccitante era un banale incidente… carne, tendini e ossa cadevano in grandi quantità… ci furono molti morti.”1 Da allora, altri termini descrittivi sono stati usati per caratterizzare le NSTI, come “ulcera fagedenica, fagedena gangrenosa, ulcera gangrenosa, ulcera maligna, ulcera putrida, o gangrena ospedaliera. “2 Il termine gangrena è ancora usato, come nella gangrena di Fournier, che è necrosi del perineo e dello scroto.3
Epidemiologia
Il rischio di NSTI rimane complessivamente basso, con circa 1.000 casi all’anno negli Stati Uniti. Questo numero può essere in aumento, tuttavia, forse a causa di una maggiore consapevolezza e riconoscimento dello stato della malattia, di una crescente resistenza agli antibiotici o di una maggiore capacità di virulenza batterica.4
Eziologia
Le NSTI sono classificate in base alla sede anatomica (ad esempio, gangrena di Fournier), ma più comunemente si verificano nelle estremità, nel perineo e nei genitali. I comuni organismi causali batterici includono Staphylococcus aureus meticillino-resistente (MRSA), organismi gram-negativi e anaerobi, e streptococchi di gruppo A (GAS).4
Presentazione clinica e diagnosi
La presentazione iniziale dei pazienti con NSTI può imitare i sintomi associati alla cellulite, compresi eritema, gonfiore, febbre, indurimento ed edema al di fuori dell’area dei cambiamenti della pelle.4 I pazienti possono descrivere indolenzimento o dolore simile a quello di un muscolo tirato.5 I sintomi che dovrebbero aumentare il sospetto del medico di NSTI includono un dolore sproporzionato rispetto ai risultati dell’esame (all’inizio del decorso della malattia), la presenza di bolle, ecchimosi cutanee che precedono la necrosi della pelle, gas nei tessuti e anestesia cutanea. Inoltre, rispetto ai pazienti con diagnosi di cellulite, la cronologia dell’infezione nei pazienti con NSTI indica una progressione della malattia molto più rapida.4 Pertanto, i pazienti con sospetto di cellulite devono escludere la diagnosi di fascite necrotizzante.6 Perché si verifichi un’infezione, i batteri devono entrare nel flusso sanguigno, di solito attraverso una ferita incitante (una rottura della superficie epiteliale o mucosa) come un taglio o un graffio minore, una puntura di insetto, un’ulcera cutanea o una ferita post-operatoria; tuttavia, a volte tali lesioni non possono essere identificate. I fattori di rischio per le NSTI includono uno stato immunocompromesso (AIDS, terapia steroidea), obesità, abuso di alcol, cancro, diabete mellito, malattia vascolare periferica, malattia renale, malnutrizione e altre condizioni croniche. Anche l’uso attivo di droghe parenterali (iniezione endovenosa o sottocutanea di sostanze illecite) è stato identificato come un fattore di rischio, in particolare nel contesto urbano.7
Rassegna delle linee guida
Le linee guida 2014 della Infectious Diseases Society of America (IDSA) per la diagnosi e la gestione delle infezioni della pelle e dei tessuti molli contengono informazioni sulla gestione di tutti i tipi di infezioni della pelle e dei tessuti molli, dalla semplice cellulite al carbonchio cutaneo in individui sani e pazienti compromessi. Poiché queste infezioni si verificano in tutti i gruppi di età, le linee guida forniscono raccomandazioni sia per i pazienti pediatrici che per quelli adulti. Una sottosezione delle linee guida fornisce informazioni relative alle NSTI. Le raccomandazioni specifiche per il trattamento sono fornite sulla base di una valutazione che indica la forza dell’evidenza per la raccomandazione secondo il sistema di classificazione IDSA/U.S. Public Health Service per la valutazione delle raccomandazioni nelle linee guida cliniche.6 La linea guida fornisce risposte a 24 domande cliniche, incluse due domande relative alle NSTI.
La prima domanda relativa alle NSTI affrontata dalle linee guida è: Qual è la valutazione e il trattamento preferibile della fascite necrotizzante, compresa la gangrena di Fournier? La prima raccomandazione è per una pronta consultazione chirurgica nei pazienti con infezioni aggressive con segni di tossicità sistemica o se c’è preoccupazione per la fascite necrotizzante o la gangrena gassosa.6 Questa è seguita da due raccomandazioni relative alla terapia antibiotica. La terapia antimicrobica iniziale dovrebbe essere ampia, al fine di fornire una copertura sia per le infezioni da un singolo organismo che per quelle da più organismi. Inoltre, la penicillina in combinazione con la clindamicina è raccomandata per la fascite necrotizzante da GAS documentata. Tutte e tre le raccomandazioni hanno una valutazione di forte con prova di bassa qualità, indicante che gli effetti desiderabili superano chiaramente tutti gli effetti indesiderabili. Dopo le raccomandazioni, viene data una revisione delle prove, seguita da una revisione delle caratteristiche cliniche più comuni, delle cause microbiologiche (monomicrobiche contro polimicrobiche), della diagnosi e del trattamento.
Una sezione separata delle linee guida si concentra sulla gestione della NSTI clostridiale secondo la seguente domanda: Qual è l’approccio appropriato alla valutazione e al trattamento della gangrena gassosa clostridiale o della mionecrosi? In primo luogo, è necessario eseguire un’esplorazione chirurgica urgente del sito sospetto di gangrena gassosa e lo sbrigliamento del tessuto coinvolto. La terapia antibiotica ad ampio spettro è suggerita a meno che non ci sia una causa microbiologica definitiva. In caso di mionecrosi clostridiale, si suggerisce la penicillina in combinazione con la clindamicina. Infine, l’ossigenoterapia iperbarica non è raccomandata. Tutti questi suggerimenti hanno una raccomandazione forte, e tutti, tranne la raccomandazione chirurgica, hanno una bassa qualità delle prove (la raccomandazione chirurgica ha una qualità moderata delle prove). Una revisione delle prove che circondano queste raccomandazioni conclude la sezione sulle NSTI.6
Oltre a differire dalle infezioni cutanee meno gravi per presentazione clinica e altre manifestazioni sistemiche, le NSTI richiedono un approccio diverso al trattamento. Ci sono molte varietà di NSTI, ma il trattamento antibiotico e l’approccio chirurgico sono simili per tutti i tipi, e l’intervento chirurgico è l’approccio primario quando si prevede una NSTI. La maggior parte dei pazienti richiederà più visite in sala operatoria (OR) fino a quando lo sbrigliamento non sarà più necessario.6
Trattamento farmacologico
La selezione iniziale degli antibiotici dovrebbe comprendere agenti con attività contro un’ampia gamma di organismi, compresi aerobi, MRSA e anaerobi (TABELLA 1).6 Nella selezione degli antibiotici devono essere considerati fattori specifici del paziente come la precedente esposizione agli antibiotici, stati patologici concomitanti, disfunzioni d’organo e allergie. Come nel caso della gestione della maggior parte delle infezioni, una buona stewardship antimicrobica include l’ottimizzazione della terapia antibiotica allo spettro più stretto una volta identificata una causa microbiologica.
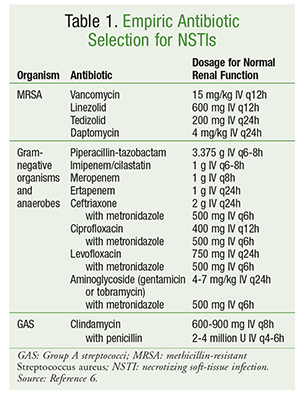
La gestione definitiva delle NSTI coinvolge una varietà di agenti antibiotici. Per le infezioni polimicrobiche, la terapia antibiotica ad ampio spettro è spesso continuata. In presenza di infezioni causate da GAS, dovrebbero essere usati sia la clindamicina che la penicillina. L’aggiunta della clindamicina sopprime la produzione di tossine e citochine, e l’uso della penicillina fornisce una copertura in caso di resistenza alla clindamicina nel GAS. Per le infezioni causate da S aureus sensibili alla meticillina, l’uso di nafcillina, oxacillina o cefazolina è preferito. Le infezioni clostridiali dovrebbero essere gestite con clindamicina in combinazione con penicillina. La terapia antibiotica è tipicamente continuata fino a quando non è necessario un ulteriore debridement, il paziente ha mostrato un miglioramento clinico e la febbre è stata assente per 48-72 ore.6
Dopo la pubblicazione delle linee guida IDSA 2014, diversi nuovi antibiotici sono stati approvati per l’uso nella gestione delle infezioni complicate della pelle e dei tessuti molli. Questi agenti sono tedizolid (Sivextro), oritavancin (Orbactiv) e dalbavancin (Dalvance).
Tedizolid è un antibiotico oxazolidinone simile al linezolid. Ha un’attività affidabile contro MRSA e altri organismi gram-positivi multidrug-resistant. In contrasto con il dosaggio due volte al giorno del linezolid, il tedizolid è somministrato in una singola dose giornaliera, per via orale o IV. Il tedizolid può avere profili di effetti avversi e interazioni farmacologiche più favorevoli rispetto al linezolid.8 Sebbene il tedizolid sia stato studiato nella gestione delle infezioni batteriche acute della pelle e delle strutture cutanee, non è stato studiato nelle NSTI.
Dalbavancin e oritavancin sono lipoglicopeptidi approvati per la gestione delle infezioni batteriche acute della pelle e delle strutture cutanee. Questi agenti sono unici in quanto hanno una lunga emivita, consentendo un regime a dose singola o un regime monosettimanale. Il dosaggio di dalbavancin deve essere ridotto nei pazienti con una clearance della creatinina <30 mL/minuto. Oritavancin non richiede alcun aggiustamento della dose legato a disfunzioni d’organo, ma non deve essere usato in pazienti che ricevono eparina perché prolunga artificialmente i test di coagulazione. L’oritavancina può anche aumentare gli effetti degli antagonisti della vitamina K come il warfarin.9 Entrambi gli agenti hanno dimostrato efficacia nella gestione delle infezioni della pelle e delle strutture cutanee, ma non sono stati valutati per l’uso nelle infezioni necrotizzanti.
Le terapie aggiuntive per le NSTI includono immunoglobulina IV (IVIG) e ossigenoterapia iperbarica. Si pensa che l’IVIG sia utile a causa della possibile neutralizzazione delle tossine prodotte nelle infezioni da streptococco. La riduzione di queste tossine potrebbe potenzialmente diminuire alcune delle insufficienze d’organo, lo shock e la distruzione dei tessuti spesso osservati nelle NSTI.6 Al momento della pubblicazione delle linee guida IDSA (aprile 2014), uno studio osservazionale e un trial europeo hanno riportato alcuni successi nell’uso dell’IVIG nelle infezioni streptococciche.6 Tuttavia, sulla base della mancanza di prove a sostegno dell’efficacia, l’uso dell’IVIG non è attualmente raccomandato.
Uno studio più recente ha descritto l’efficacia della clindamicina e dell’IVIG contro le infezioni invasive da GAS.10 Ottantaquattro pazienti hanno soddisfatto i criteri per la malattia invasiva da GAS e l’IVIG è stata utilizzata in 14 pazienti, tra cui otto con fascite necrotizzante. La mortalità era più bassa nei pazienti trattati con clindamicina e IVIG, ma questa differenza non era significativa. Anche se non c’era una differenza statistica nella mortalità quando l’IVIG è stata aggiunta alla clindamicina, gli autori hanno suggerito che ci può essere un possibile beneficio negli adulti con malattia più grave.10
L’ossigenoterapia iperbarica (HBOT) è stata raccomandata per la gestione della gangrena gassosa, ma il suo ruolo è controverso.6 Studi di laboratorio hanno dimostrato che gli stati tissutali ricchi di ossigeno aiutano a sopprimere la crescita del Clostridium perfringens e ad aumentare le difese dell’ospite contro le cellule estranee, ma mancano i criteri per identificare i pazienti che possono trarre beneficio e il momento appropriato per iniziare la terapia.6,11 Nulla dovrebbe ritardare lo sbrigliamento chirurgico d’urgenza e la somministrazione di antibiotici, poiché entrambi sono importanti per garantire la sopravvivenza.6
Poiché la maggior parte degli studi pubblicati erano piccoli e sottopotenziati, è stato condotto uno studio per valutare i dati sull’uso dell’HBOT da diversi centri con strutture HBOT.11 In un periodo di 3 anni, 14 strutture HBOT hanno visto 1.583 casi di NSTI e fornito HBOT adiuvante in 117 casi. Il gruppo HBOT ha avuto costi maggiori e una maggiore durata della degenza rispetto al gruppo di controllo, ma ha avuto un tasso di mortalità ospedaliera significativamente inferiore (5% vs. 12%, rispettivamente; P <.05). Quando è stata considerata la gravità della malattia, i pazienti HBOT più gravemente malati hanno avuto tassi significativamente più bassi di mortalità e complicazioni, ma non ci sono state differenze nella durata della degenza o nei costi. Un’analisi multivariata ha dimostrato che i pazienti che non hanno ricevuto l’HBOT avevano più probabilità di morire durante il ricovero (odds ratio, 10,6; 95% CI 5,2-25,1). Ogni aumento della gravità della malattia comportava un aumento del rischio di morte.
Questo studio su 14 strutture di HBOT sembra mostrare risultati migliori, soprattutto per i pazienti più malati ammessi direttamente in un centro in grado di fornire questo trattamento.11 Tuttavia, questo non placa la controversia che circonda l’uso dell’HBOT, in quanto questa indagine aveva diverse limitazioni. Lo studio è stato condotto retrospettivamente utilizzando un database amministrativo di centri medici accademici. Inoltre, alcuni centri possono avere una terza parte che possiede la struttura HBOT, rendendo i risultati meno generalizzabili ai pazienti di quelle istituzioni. Uno studio randomizzato e controllato sarebbe utile per determinare il beneficio finale di questa terapia.
Complicazioni
Il tasso di mortalità associato alla NSTI è del 30-70% nei pazienti con fascite necrotizzante da GAS combinata con ipotensione e insufficienza d’organo.6 Poiché il trattamento comporta più visite in sala operatoria, vengono abitualmente riportate grandi ferite e possibili amputazioni. Altre complicazioni, come la chirurgia ricostruttiva, la sepsi, le infezioni nosocomiali e il tempo prolungato di assistenza critica dovuto allo sviluppo di insufficienza d’organo multisistemica, sono complicazioni frequenti delle NSTI.12
Le informazioni sugli effetti a lungo termine delle NSTI sono state raccolte da interviste approfondite di 18 sopravvissuti.12,13 Gli investigatori hanno scoperto che la qualità della vita riportata era significativamente influenzata dalla funzione fisica e dal dolore continuo. Anche l’effetto dell’esperienza sulla famiglia e su altre relazioni è stato scoperto essere significativo. Diversi sopravvissuti hanno descritto le conseguenze psicologiche a lungo termine della malattia, tra cui la depressione e lo stress post-traumatico.
Conclusione
I farmacisti ospedalieri sono molto adatti ad assistere nella cura dei pazienti con NSTI, tra cui la razionalizzazione delle cure, la promozione della stewardship antimicrobica e il miglioramento degli esiti clinici, la riduzione dei costi, la minimizzazione delle complicazioni e le riammissioni. Altri ruoli del farmacista includono l’identificazione dei pazienti ideali per i nuovi ma più costosi agenti terapeutici (per esempio, oritavancin) e il riconoscimento delle interazioni farmacologiche (cioè, anticoagulanti) con queste classi di antibiotici.
1. Descamps V, Aitken J, Lee MG. Ippocrate sulla fascite necrotizzante. Lancet. 1994;344:556.
2. Loudon I. Fascite necrotizzante, gangrena ospedaliera e fagedena. Lancet. 1994;344:1416-1419.
3. Sarani B, Strong M, Pascual J, Schwab CW. Fascite necrotizzante: concetti attuali e revisione della letteratura. J Am Coll Surg. 2009;208:279-288.
4. Hakkarainen TW, Kopari NM, Pham TN, Evans HL. Infezioni necrotizzanti dei tessuti molli: revisione e concetti attuali nel trattamento, sistemi di cura e risultati. Curr Probl Surg. 2014;51:344-362.
5. CDC. Fascite necrotizzante: una malattia rara, soprattutto per la salute. www.cdc.gov/features/necrotizingfasciitis/. Accessed November 29, 2016.
6. Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 aggiornamento della Infectious Diseases Society of America. Clin Infect Dis. 2014;59:147-159.
7. Bosshardt TL, Henderson VJ, Organ CH Jr. infezioni necrotizzanti dei tessuti molli. Arch Surg. 1996;131:846-852.
8. Kisgen JJ, Mansour H, Unger NR, Childs LM. Tedizolid: un nuovo antimicrobico oxazolidinone. Am J Health Syst Pharm. 2014;71:621-633.
9. Roberts KD, Sulaiman RM, Rybak MJ. Dalbavancin e oritavancin: un approccio innovativo al trattamento delle infezioni gram-positive. Farmacoterapia. 2015;35:935-948.
10. Carapetis JR, Jacoby P, Carville K, et al. Efficacia di clindamicina e immunoglobulina endovenosa, e rischio di malattia nei contatti, nelle infezioni invasive da streptococco di gruppo A. Clin Infect Dis. 2014;59:358-365.
11. Shaw JJ, Psoinos C, Ernhoff TA, et al. Non solo pieno di aria calda: l’ossigenoterapia iperbarica aumenta la sopravvivenza nei casi di infezioni necrotizzanti dei tessuti molli. Surg Infect (Larchmt). 2014;15:328-335.
12. Hakkarainen TW, Burkette Ikebata N, Bulger E, Evans HL. Andare oltre la sopravvivenza come misura del successo: comprendere l’esperienza del paziente delle infezioni necrotizzanti dei tessuti molli. J Surg Res. 2014;192:143-149.
13. Miller LG, Perdreau-Remington F, Rieg G, et al. Fascite necrotizzante causata da Staphylococcus aureus meticillino-resistente associato alla comunità a Los Angeles. New Engl J Med. 2005;352:1445-1453.