Ha bisogno di conoscere alcune proprietà di base del composto dato e la sua struttura di Lewis per capire la sua geometria molecolare, polarità, e altre proprietà simili. SF4 è una formula chimica per il tetrafluoruro di zolfo. È un gas corrosivo incolore che viene usato nella sintesi di diversi composti organofluorati. L’SF4 è un composto piuttosto pericoloso, ma è ampiamente utilizzato nelle aziende chimiche e farmaceutiche.
| Nome della molecola | Tetrafluoro di zolfo ( SF4) |
| No degli elettroni di valenza nella molecola | 34 |
| Ibridizzazione di SF4 | sp3 ibridazione |
| Angoli di legame | 102 gradi e 173 gradi |
| Geometria molecolare di SF4 | Trigonale bipiramidale |
Per capire le proprietà di questa molecola, come la sua reattività, polarità e altro, bisogna prima conoscere la struttura di Lewis dell’SF4.
Contenuti
Geometria molecolare dell’SF4
È facile capire la geometria molecolare di una data molecola usando la formula molecolare o il modello VSEPR. Una formula molecolare aiuta a conoscere il numero esatto e il tipo di atomi presenti nel composto dato. Qui c’è un atomo di zolfo e quattro atomi di fluoro nel composto, che lo rende simile alla formula molecolare di AX4E.
Le molecole che hanno una formula molecolare di AX4E hanno una geometria molecolare trigonale bipiramidale. Qui due atomi di fluoro che formano legami con l’atomo di zolfo sono sulle posizioni equatoriali, e gli altri due sono sulle posizioni assiali. Poiché c’è una coppia solitaria sull’atomo centrale, essa respinge la coppia di elettroni di legame, il che modifica un po’ la forma e la fa apparire come un’altalena. Gli elettroni seguono questo schema di disposizione seguendo la regola VSEPR per minimizzare le forze di repulsione tra le coppie di elettroni solitari per massimizzare la stabilità della molecola.
Quindi, SF4 ha una geometria molecolare trigonale bipiramidale.
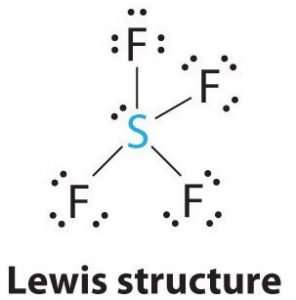
SF4 Struttura di Lewis
La struttura di Lewis è una rappresentazione grafica dei legami e degli elettroni di valenza nella molecola. I legami formati tra due atomi sono rappresentati da linee, mentre gli elettroni di valenza che non formano alcun legame sono mostrati da punti. Gli elettroni di valenza che partecipano alla formazione dei legami sono chiamati coppie di elettroni di legame, mentre gli elettroni che non partecipano o non formano alcun legame sono chiamati coppie di elettroni non leganti o coppie solitarie.
E per disegnare la struttura di Lewis di SF4, dobbiamo prima conoscere il numero totale di elettroni di valenza in questa molecola.
Come si può probabilmente vedere, c’è un atomo di zolfo in questo composto e quattro atomi di fluoro. Per conoscere gli elettroni di valenza totali di questo composto, abbiamo bisogno di conoscere gli elettroni di valenza di entrambi gli atomi singolarmente.
- elettroni di valenza dello zolfo: 6
- elettroni di valenza del fluoro: 4* (7)
( poiché ci sono quattro atomi di fluoro, dobbiamo considerare gli elettroni di valenza di tutti gli atomi)
Numero totale di elettroni di valenza in SF4 = numero di elettroni di valenza in zolfo + numero di elettroni di valenza in fluoro
= 6 + 28
= 34 elettroni di valenza
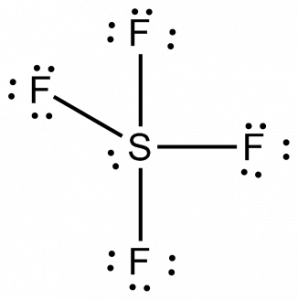
Ora che conosciamo il numero totale di elettroni di valenza, diventerebbe facile per noi capire la formazione del legame tra gli atomi e anche la disposizione completa della molecola.
Lo zolfo sarà l’atomo centrale di questa molecola perché è il meno elettronegativo, con quattro atomi di fluoro che formano legami ai lati di questo atomo centrale. Ogni atomo di fluoro formerà un legame con l’atomo centrale, il che significa che ci saranno quattro legami nella struttura della molecola utilizzando quattro elettroni di valenza degli atomi di fluoro e 4 elettroni dell’atomo di zolfo. Così ora, otto elettroni di valenza sono utilizzati, riducendo il numero di elettroni di valenza da 34 a 24. Tutti gli atomi di fluoro hanno sei elettroni di valenza, e l’atomo centrale ha due elettroni di valenza.
Disegna le linee tra S e F per mostrare i legami e per le coppie solitarie di elettroni, usa i punti. Ogni atomo di fluoro avrà tre coppie di 6 elettroni di valenza (indicati come punti) sull’atomo, insieme a un legame con lo zolfo. Al contrario, l’atomo centrale avrà due elettroni di valenza e quattro legami.
Quindi, l’atomo centrale, lo zolfo, avrà una coppia solitaria di elettroni e quattro coppie di elettroni di legame nella struttura di Lewis di SF4. Allo stesso tempo, ogni atomo di fluoro avrà tre coppie solitarie.
SF4 è polare?
Una volta che conosciamo la struttura di Lewis e la geometria molecolare del composto dato, diventa più facile rappresentare la polarità della molecola. Qui, una coppia solitaria sull’atomo di zolfo centrale e quattro coppie di elettroni di legame portano alla distribuzione asimmetrica degli elettroni sull’atomo centrale.
Inoltre, poiché la forma della molecola è come un’altalena, due atomi di fluoro possono annullare il momento di dipolo dell’altro, ma gli altri due non possono a causa della disposizione degli elettroni. E poiché gli atomi di fluoro sono più elettronegativi dell’atomo di zolfo, ne risulta una distribuzione non uniforme della carica. Quindi il momento di dipolo non è annullato, il che rende la molecola polare. Quindi sì, SF4 è polare.
Ibridazione di SF4
Per conoscere l’ibridazione della molecola SF4, guardiamo prima le regioni di densità di elettroni per l’atomo centrale.
Lo zolfo ha quattro coppie di elettroni di legame e una coppia solitaria, rendendo il suo numero totale di regioni di densità elettronica 5. Quindi l’atomo di zolfo usa cinque orbitali ibridati, un orbitale 3s, tre orbitali 3p e un orbitale 3d. Questa disposizione degli elettroni intorno all’atomo e degli orbitali ibridati porta all’ibridazione sp3d. Si può anche usare il numero sterico per conoscere l’ibridazione; qui, il numero sterico è 5 per l’atomo di zolfo.
Quindi SF4 ha ibridazione sp3d.
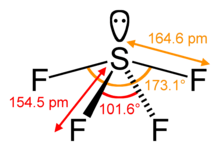
SF4 Angoli di legame e forma
L’atomo di zolfo centrale forma quattro legami con gli atomi di fluoro vicini e ha una coppia solitaria di elettroni. Gli atomi di fluoro sulle posizioni equatoriali hanno angoli di legame di 102 gradi, e quelli assiali hanno 173 gradi, che sono un po’ diversi dalla geometria molecolare bipiramidale trigonale che porta ad una forma ad onda.
La coppia solitaria sull’atomo centrale porta al cambiamento degli angoli di legame da 120 gradi a 102 gradi per gli atomi di fluoro equatoriali e 173 gradi invece di 180 gradi per gli atomi di fluoro assiali.
Osservazioni conclusive
Per concludere tutte le proprietà possiamo dire che,
- Il tetrafluoruro di zolfo ha 34 elettroni di valenza, di cui forma quattro legami covalenti e una coppia solitaria di elettroni sull’atomo centrale nella struttura di Lewis.
- Ci sono tre coppie solitarie su ogni atomo di fluoro.
- Ha una geometria molecolare della formula AX4E; forma una forma a sega e ha una geometria molecolare trigonale bipiramidale.
- SF4 ha ibridazione sp3d ed è polare in natura.