- Introduzione
- Metodi
- Fibroblasti di topo
- Diagnosi dei pazienti e farmaci
- Set-Up sperimentale
- Misurazione del periodo refrattario effettivo
- Stock Solutions and Drug Application
- Analisi dei parametri del potenziale d’azione
- Analisi statistica
- Risultati
- Effetti di MK-0448 sulla corrente Kv1.5
- Effetti di MK-0448 sui potenziali d’azione
- Discussione
- Limiti dello studio
- Conclusione
- Dichiarazione di conflitto di interessi
- Riconoscimenti
Introduzione
Alla ricerca di farmaci antiaritmici più sicuri per il trattamento della fibrillazione atriale (FA), inibitori selettivi di IKur sono stati progettati come agenti antiaritmici atriali selettivi di classe III con potenziale terapeutico nella FA. Poiché hanno come bersaglio i canali Kv1.5 che sono funzionali solo negli atri (Mays et al., 1995), questi agenti sono considerati privi di effetti proaritmici nei ventricoli e quindi hanno ricevuto molto interesse nella comunità scientifica (per la revisione vedi Ford e Milnes, 2008; Tamargo et al, 2009; Ravens, 2010; Ravens e Wettwer, 2011).
Abbiamo precedentemente studiato gli effetti elettrofisiologici di diversi inibitori IKur, tra cui 4-aminopiridina, AVE0118, XEN-D0101, che hanno tutti elevato la fase di plateau dei potenziali d’azione atriali destri umani (AP) registrati in trabecole di appendice atriale ottenuti da pazienti in ritmo sinusale (SR) o AF (Wettwer et al, 2004; Christ et al., 2008; Ford et al., 2013). È interessante notare che la durata del potenziale d’azione (APD90) e il periodo refrattario effettivo (ERP) sono stati accorciati in SR ma prolungati nelle preparazioni AF.
Recentemente, sono stati pubblicati i risultati della prima volta nell’uomo con un altro inibitore selettivo Kv1.5, MK-0448 (Pavri et al., 2012). MK-0448 non è riuscito a influenzare l’ERP atriale relativo in volontari sani, e gli autori hanno concluso che il blocco IKur non può essere previsto per esercitare effetti antiaritmici terapeuticamente utili nella FA. Poiché non si sa nulla sugli effetti di MK-0448 nel tessuto atriale umano ex-vivo, abbiamo studiato i suoi effetti sulle forme di AP atriali e ERP con tecniche standard di microelettrodi in trabecole isolate da appendici atriali destre di pazienti in SR e AF, che hanno dovuto subire un intervento a cuore aperto. Nelle preparazioni SR, MK-0448 elevato il potenziale di plateau e accorciato APD e ERP a 1 Hz come previsto dai bloccanti IKur. Confermiamo anche che MK-0448 blocca efficacemente la corrente Kv1.5 nei fibroblasti di topo che esprimono stabilmente il gene hKCNA5.
Metodi
Fibroblasti di topo
Le cellule HK2BN9 che esprimono canali Kv1.5 umani sono state gentilmente fornite dal dottor Tamkun (Snyders et al., 1993). Le cellule sono state coltivate in Dulbecco’s modified eagle medium contenente 10% di siero fetale di vitello e 1% di penicillina/streptomicina in condizioni atmosferiche del 5% di CO2 a 37°C. 250 μg/ml G418 è stato aggiunto al mezzo per la selezione. L’espressione di Kv1.5 è stata indotta trattando le cellule con 1 μM di desametasone 24 ore prima di un esperimento. Le cellule sono state studiate con un singolo elettrodo standard whole-cell voltage-clamp set-up come descritto in precedenza (Radicke et al., 2006). La soluzione del bagno conteneva (in mM): NaCl 150, KCl 5.4, MgCl2 2, CaCl2 2.0, HEPES 10, glucosio 10, pH 7.4, temperatura 25°C. La soluzione dell’elettrodo conteneva (in mM): KCl 40, potassio aspartato 80, NaCl 8, CaCl2 2, MgATP 5, EGTA 5, GTP 0.1, HEPES 10, pH 7.4 regolato con KOH. Le resistenze in serie erano comprese tra 5 e 10 MΩ e sono state compensate fino all’85%. La capacità delle cellule è stata misurata con piccoli passi di clamp iperpolarizzante da -40 mV a -42 mV, il valore medio era 20,8 ± 1,2 pA/pF (n = 33) e non differiva tra le cellule testate a 0,5 e 3 Hz. Tensione generazione di impulsi clamp, la raccolta dei dati e l’analisi sono stati eseguiti con il software ISO2 (MFK, Niedernhausen, Germania). I dati non sono stati corretti per il potenziale di giunzione che era 11,7 mV, come calcolato con il software JPCalc (P.H. Barry, Sydney, Australia).
Diagnosi dei pazienti e farmaci
Il tessuto atriale è stato ottenuto da pazienti sottoposti a chirurgia cardiaca a causa di malattia coronarica o valvolare. Tutti i pazienti hanno dato il consenso informato scritto. Lo studio è stato approvato dal comitato etico della Facoltà di Medicina dell’Università di Dresda (No. EK790799). I pazienti sono elencati nella tabella 1. Lo studio comprendeva 13 preparati esposti ai farmaci e 9 TMC da pazienti in ritmo sinusale (gruppo SR), 9 preparati esposti ai farmaci e 9 TMC da pazienti con fibrillazione atriale permanente (gruppo AF, definito come fibrillazione atriale permanente per ≥ 6 mesi al momento della raccolta del tessuto), e 3 preparati esposti ai farmaci da pazienti con FA intermittente (episodi di AF a terminazione spontanea della durata di pochi secondi fino a diverse ore). I farmaci dei pazienti includevano tipicamente ACE-inibitori, β-bloccanti, nitrati, farmaci per la riduzione dei lipidi e diuretici.
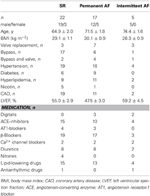
Tabella 1. Caratteristiche dei pazienti le cui trabecole sono state utilizzate per l’esposizione ai farmaci.
Set-Up sperimentale
Piccoli pezzi (50-100 mg di peso) di appendici atriali destre umane sono stati trasportati in laboratorio in una speciale soluzione di trasporto senza Ca2+ a 20-25°C, composizione in mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgSO4, 50 taurina, 5 MOPS, 30 2,3-butano-dione monoxima (BDM), pH 7,0. Sia trabecole free-running (<1 mm di diametro e 2-5 mm di lunghezza) o trabecole insieme con allegato parete atriale sono stati sezionati e montati sul fondo di un bagno organo 5 ml perfuso con 50 ml di ricircolo, soluzione di Tyrode ossigenato ad una velocità di flusso di 7 ml/min a 36 ± 1 ° C (composizione in mM: 126.7 NaCl, 0,42 NaH2PO4, 22 NaHCO3, 5,4 KCl, 1,8 CaCl2, 1,5 MgCl2, pH 7,4 in equilibrio con 5% CO2 in O2). I preparati sono stati stimolati elettricamente ad un tasso basale di 1 Hz con stimoli isolati ad onda quadra di 1 ms di durata, 2 volte l’intensità della soglia. I potenziali di transmembrana sono stati registrati con microelettrodi di vetro riempiti con 2,5 M KCl. Le resistenze di punta degli elettrodi erano comprese tra 20 e 80 MΩ. Sia la temporizzazione degli stimoli di guida e pre-elaborazione delle risposte potenziali transmembrana sono stati effettuati con un computer-aided sistema di registrazione del potenziale d’azione (Wettwer et al., 2004). Chart per Windows, versione 7.3.5, programma di registrazione (ADInstruments Pty Ltd., Castle Hill, Australia) è stato utilizzato per l’analisi dei parametri del potenziale d’azione.
Ogni esperimento è stato preceduto da un periodo di equilibrio di 60 minuti durante il quale le preparazioni sono stati autorizzati a stabilizzare e BDM residuo è stato completamente lavato via. I valori numerici dei principali parametri del potenziale d’azione dovevano rimanere costanti, cioè entro un intervallo di ±5% per almeno 10 min. Quando il microelettrodo si è spostato fuori dalla cella, un nuovo impalamento è stato fatto nello stesso posto e l’esperimento è stato continuato se la nuova registrazione non differiva da quella vecchia per giudizio visivo e mostrava meno del 3% di differenza all’analisi numerica finale.
Misurazione del periodo refrattario effettivo
Il periodo refrattario effettivo (ERP) è stato misurato da un singolo stimolo extra interpolato dopo treni di 10 impulsi di stimolazione regolari alla frequenza basale di 1 Hz con intervalli decrescenti a passi di 5 ms dall’ultimo impulso regolare fino a quando lo stimolo extra non è riuscito a suscitare un potenziale d’azione. Dopo un breve periodo di recupero, la preparazione è stata esposta a MK-0448 (3 μM) a 1 Hz per altri 60 minuti e l’ERP è stato testato ancora una volta in presenza del farmaco.
Stock Solutions and Drug Application
MK-0448 è stato sintetizzato da Xention Ltd. Cambridge UK. In alcuni esperimenti, MK-0448 è stato applicato in concentrazioni cumulativamente crescenti aggiungendo direttamente aliquote da una soluzione stock di 10 mM con DMSO come solvente a 50 ml del mezzo di circolazione del bagno. La concentrazione di DMSO non ha mai superato lo 0,2%, una concentrazione che non ha indotto alcun cambiamento significativo quando applicata da sola. I preparati sono stati esposti ad ogni concentrazione di MK-0448 per 20 minuti.
Analisi dei parametri del potenziale d’azione
Sono stati analizzati i seguenti parametri standard degli AP atriali: potenziale di membrana a riposo, RMP (mV), ampiezza del potenziale d’azione, APA (mV), durata del potenziale d’azione al 20, 50 e 90% della ripolarizzazione, APD20, APD50 e APD90 (ms), velocità massima di depolarizzazione, dV/dtmax (V/s) e il “potenziale di plateau” definito come il potenziale di membrana medio assoluto (mV) nella finestra temporale tra il 20 e il 30% di APD90 (PLT20). Le preparazioni con potenziali di riposo meno negativi di -65 mV e ampiezze inferiori a 80 mV sono state scartate.
Analisi statistica
GraphPad Prism (versione 4.03) è stato utilizzato per le analisi statistiche. Nelle curve concentrazione-risposta (vedi tabella 2) i valori ottenuti a concentrazioni crescenti sono stati confrontati con i controlli pre-farmaco tramite One-Way ANOVA seguita dal test di confronto multiplo di Bonferroni. I singoli parametri del potenziale d’azione delle preparazioni SR e AF permanente in presenza di 3 μM MK-0448 sono stati confrontati con i controlli pre-farmaco tramite il test t di Student (vedi Tabella 3). Le differenze sono considerate statisticamente significative per P < 0,05.

Tabella 2. Effetti dipendenti dalla concentrazione di MK-0448 a 1, 3, e 10μM (1 Hz).
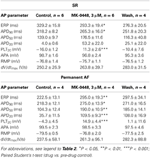
Tabella 3. Effetti di MK-0448 (3μM) sui parametri del potenziale d’azione e sul periodo refrattario effettivo (ERP) delle trabecole atriali destre umane di pazienti in SR e AF (frequenza di stimolazione 1 Hz).
Risultati
Effetti di MK-0448 sulla corrente Kv1.5
Kv1.5, che è stato misurato durante i cambiamenti di potenziale passo da un potenziale di mantenimento di -60 mV a vari potenziali di prova tra -40 e +80 mV aveva un potenziale di soglia di -30 mV, attivato rapidamente e difficilmente inattivato entro 500 ms (dati non mostrati). Per i test di droga abbiamo scelto 50 ms di durata passi di tensione-clamp a +50 mV che ha suscitato ampiezze medie di corrente di 85.0 ± 10.5 pA / PF a 0.5 Hz (n = 16) e 110.6 ± 16.9 pA / PF a 3 Hz n = 17, P = 0.2133). MK-0448 (100 nM) bloccato Kv1.5 ampiezza corrente in modo dipendente dalla frequenza (Figura 1A). A 0.5 Hz, il blocco ha raggiunto uno steady-state entro 5-10 min di applicazione del farmaco e parzialmente recuperato durante un periodo di 5 minuti durante il quale la cella è stata continuamente bloccato a -60 mV (Figura 1B). Quando le cellule sono state esposte a MK-0448 durante un periodo di 5 min tenuto a -60 mV, per mantenere i canali in stato chiuso, IKv1.5 del primo impulso post-riposo non era diverso da quello pre-riposo. Impulsi successivi in presenza di droga ha rivelato un rapido inizio di inibizione, aumentando con ogni impulso fino a raggiungere lo stato stazionario (Figura 1C). MK-0448 (100 nM) ridotto IKv1.5 da 82,3 ± 31,5 pA / FP a 22,4 ± 6,0 pA / FP (n = 5) entro 3 min di tensione continua-clamp passi a 0,5 Hz, e da 113,8 ± 52,7 pA / FP a 12,9 ± 2,5 pA / FP a 3 Hz (n = 4). Questi risultati sono coerenti con l’inibizione MK-0448 di Kv1.5 essere condizionata all’attivazione del canale.

Figura 1. Effetti di MK-0448 sulle correnti Kv1.5 misurate in cellule HK2BN9 a 25°C. (A) Tensione clamp e tracce di corrente ottenuti prima (nero) e dopo la superfusione delle cellule con 100 nM MK-0448 (verde) per 10 min. Tasso di impulsi clamp come indicato. (B) L’inizio dell’effetto di blocco di MK-0448 (100 nM) sul picco Kv1.5 corrente e il recupero dal blocco durante 5 min al potenziale di mantenimento di -60 mV. Singole tracce di corrente in alto sono stati ottenuti nei punti di tempo indicati da piccole lettere nel grafico diario in basso. (C) L’inizio di effetto della droga dopo l’esposizione durante 5 min di bloccaggio continuo a -60 mV. Frequenza di passo: 3 Hz.
Effetti di MK-0448 sui potenziali d’azione
I potenziali d’azione registrati nelle trabecole atriali destre da pazienti in SR avevano la tipica configurazione spike-and-dome (Figura 2), nel tessuto AF permanente la forma era triangolare ed è il risultato del rimodellamento elettrico . L’effetto più sorprendente concentrazione-dipendente di MK-0448 (1-10 μM) sui potenziali d’azione SR alla frequenza di stimolazione basale di 1 Hz è stato un robusto aumento del potenziale di plateau (PLT20) (Figura 2; Tabella 2). In questa serie di esperimenti, l’APD90 tendeva ad essere accorciato (non significativo) mentre APD20 e APD50 sono stati prolungati, raggiungendo il livello di significatività statistica solo alla massima concentrazione (vedi Tabella 2). Il potenziale di membrana a riposo (RMP), l’ampiezza del potenziale d’azione (APA) e la velocità di depolarizzazione massima (dV/dtmax) non sono stati significativamente influenzati dal MK-0448 (vedi Tabella 2). Prima e dopo il trattamento con il farmaco tutte le preparazioni hanno seguito la stimolazione, anche alla concentrazione più alta.
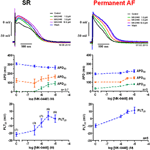
Figura 2. Effetti dipendenti dalla concentrazione di MK-0448 sui potenziali d’azione registrati nelle trabecole atriali destre di pazienti in ritmo sinusale (SR) e in fibrillazione atriale permanente (AF). Sopra: tracciati individuali per esperimenti tipici, registrati in presenza di concentrazioni crescenti di composto (vedi codice colore). Tempo di esposizione ad ogni concentrazione: 20 min; controllo: controllo pre-farmaco. Medio e basso: Valori medi ± s.e.m. da 7 esperimenti in SR e 5 in AF, di durata del potenziale d’azione a 90, 50, e 20% della ripolarizzazione (APD90, APD50, e APD20) e potenziale di plateau (PLT20). Frequenza di stimolazione: 1 Hz. Si prega di notare che non tutte le preparazioni sono state esposte all’intera gamma di concentrazioni (numeri di preparazioni indicate tra parentesi).
Gli effetti di MK-0448 su ERP sono stati studiati solo a 3 μM. Questa concentrazione ha prodotto cambiamenti massimi entro 40-50 min di applicazione del farmaco, e questi erano parzialmente reversibili dopo 60 min di washout. In 6 preparazioni da pazienti in SR, APD90, e ERP sono stati significativamente accorciati (Figura 3; Tabella 3). Effetti simili sono stati osservati in 2 preparazioni da pazienti in AF intermittente (Figura 3).
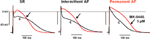
Figura 3. Effetti di MK-0448 (3 μM, traccia rossa, freccia) sui potenziali d’azione registrati nelle trabecole atriali destre di pazienti in ritmo sinusale (SR), fibrillazione atriale intermittente (iAF) e fibrillazione atriale cronica (AF). Registrazioni originali da una preparazione in ogni gruppo è mostrato. c, controllo pre-droga (traccia nera). Frequenza di stimolazione 1 Hz.
Nelle trabecole AF permanente, MK-0448 anche significativamente elevato il potenziale di plateau in misura simile a SR, ma in contrasto con SR, prolungato APD ai tre livelli di ripolarizzazione analizzati (Figure 2, 3; Tabella 3). Nelle preparazioni di AF permanente, APA, RMP, e dV/dtmax non erano anche significativamente influenzati, con l’eccezione di RMP con 10 μM MK-0448.
A causa della limitata disponibilità abbiamo potuto solo studiare gli effetti di MK-0448 in 2 trabecole da pazienti in AF intermittente, una registrazione tipica è mostrato in Figura 3; altri 3 sono stati utilizzati come TMC. Simile ai risultati nelle preparazioni SR, MK-0448 accorciato APD90 e ERP nelle 2 preparazioni intermittente AF.
In tempo-matched esperimenti di controllo con tessuto da pazienti in SR, intermittente AF, e AF, parametri di potenziale d’azione non è cambiato in modo significativo (dati non mostrati).
Discussione
I cambiamenti caratteristici nei parametri del potenziale d’azione osservati con MK-0448 nelle trabecole atriali destre umane sono coerenti con il blocco dei canali Kv1.5 come riportato in precedenza per diversi farmaci.
MK-0448 è stato descritto come altamente selettivo per i canali Kv1.5 rispetto a una vasta gamma di canali ionici cardiaci standard. canali hERG sono circa 10.000 volte, inward rectifier corrente Kir2.1 e Kir3.1/3.4 circa 1000 volte, e Kv7.1 (IKs) circa 10-100 volte meno sensibile di Kv1.5 (Pavri et al, 2012). I dati del voltage-clamp in un sistema di espressione eterologa confermano che MK-0448 (100 nM) ha prodotto un blocco robusto di Kv1.5 umano con un inizio di azione piuttosto lento e parziale recupero dal blocco a -60 mV. Anche se i nostri risultati non permettono una caratterizzazione precisa dell’interazione farmaco-canale indicano chiaramente che i canali a riposo recuperano dal blocco e l’attivazione è necessaria per lo sviluppo del blocco, suggerendo un legame preferenziale ai canali aperti e/o inattivati.
In esperimenti precedenti, abbiamo dimostrato che basse concentrazioni di 4-aminopyridine inibiscono selettivamente Iso (IKur) in miociti atriali umani (Wettwer et al., 2004). Questo bloccante ha elevato il potenziale di plateau in preparazioni SR (EC50 ~ 15 μM). Inoltre, 4-AP a concentrazioni che sono considerati selettivi per il blocco IKur significativamente accorciato APD90 in SR ma prolungato APD90 in trabecole AF permanente (Wettwer et al., 2004). Gli effetti più importanti di MK-0448 su APs atriale umano, vale a dire, elevazione del potenziale di plateau, accorciamento di APD90 in SR e prolungamento di APD20, APD50 e APD90 in AF permanente, sono in linea con i nostri precedenti risultati con altri inibitori di IKur, così che siamo sicuri di concludere che MK-0448 blocca effettivamente IKur nelle trabecole atriali umane.
A differenza dell’inibizione dei canali hERG, l’inibizione di IKs non è stata associata ad un effetto ventricolare proaritmico in modelli animali (Lynch et al., 1999). Tuttavia, la modulazione di IKs da MK-0448 potrebbe anche ridurre la riserva di ripolarizzazione nel ventricolo e diventare aritmogenica nei ventricoli in condizioni appropriate (Lynch et al., 1999). È importante notare che è difficile valutare il rischio proaritmico ventricolare di un farmaco che modula IKs in volontari sani con normale riserva di ripolarizzazione ventricolare. Pertanto, la selettività atriale di MK-0448 dovrebbe essere attentamente valutata nei pazienti.
L’accorciamento di APD90 e ERP dai bloccanti Kv1.5 nel SR è proposto per essere causato dalla marcata elevazione del potenziale di plateau in un intervallo di tensione in cui più canali hERG sono attivati, e, anche se inattivati rapidamente, possono recuperare da inattivazione a potenziali più negativi e quindi accelerare la ripolarizzazione finale (Gintant, 2000).
Oltre alle alterazioni distinte nelle forme dei potenziali d’azione, la perdita dell’adattamento alla frequenza di ERP e APD90 è stata riconosciuta come un segno distintivo del rimodellamento atriale sia nei pazienti (ad es, Attuel et al., 1982; Daoud et al., 1996) e in studi ex vivo (Franz et al., 1997; Dobrev e Ravens, 2003). Nel nostro studio attuale e nel recente studio “first-time-in-human” con MK-0448 tutti i test elettrofisiologici erano in una gamma di frequenza molto al di sotto di quella della FA e si potrebbe sostenere che sulla base dei nostri dati SR che non è sorprendente che MK-0448 non ha prolungato AERP in volontari sani (Pavri et al, 2012).
L’evidenza sperimentale e clinica suggerisce che la fibrillazione atriale è dovuta a micro-rientri innescati da focolai ectopici situati in prossimità delle vene polmonari (Haissaguerre et al., 1998). Gli interventi farmacologici per interrompere il micro-rientro devono prolungare il periodo refrattario effettivo, mentre la soppressione dei focolai ectopici richiede la riduzione dell’eccitabilità. Se MK-0448 blocca selettivamente IKur, è più probabile che aumenti la refrattarietà atriale (nella FA) piuttosto che ridurre l’eccitabilità, anche se non è chiaro come la marcata elevazione dell’ampiezza del plateau sia legata al prolungamento dell’ERP nella FA. Deve essere sottolineato, tuttavia, che la forma complessiva del potenziale d’azione cardiaco è determinata da più conduttanze ioniche, quindi l’interpretazione dei dati del potenziale d’azione non può essere conclusiva rispetto a quali canali ionici contribuiscono a un particolare cambiamento.
In SR, abbiamo anche osservato accorciamento dell’ERP con MK-0448 e non possiamo giudicare se questo è un effetto anti- o proaritmico negli atri. Infatti questo può essere risposto solo in uno studio prospettico di fase 2 in pazienti con FA. Tuttavia, vale la pena notare che nessuna proaritmia è stata riportata per MK-0448 (Pavri et al., 2012) o accorciamento di AERP in volontari sani. Anche altri inibitori di Kv1.5, ad esempio XEN-D0101, che sono stati valutati in clinica, non hanno riportato pro-aritmia (atriale o ventricolare) in volontari sani (Ford et al., 2013). Studi genetici hanno rivelato un’associazione di mutazioni “loss-of-function” nel gene KCNA5 che codifica per Kv1.5 con la FA familiare “solitaria” (Olson et al., 2006). Tuttavia, in questo studio c’era una genotipizzazione/fenotipizzazione incompleta dei membri della famiglia e nessuna prova di collegamento primario. Infatti, la probabilità di osservare questi dati solo per caso è tra il 10 e il 15%. Un recente studio su più di 300 pazienti con FA solitaria ad esordio precoce ha rivelato 3 mutazioni “gain-of-function” in KCNA5 oltre a diverse mutazioni loss-of-function, sostenendo l’ipotesi che la suscettibilità alla FA possa essere aumentata da un cambiamento nella funzione di KCNA5 (Christophersen et al, 2013).
Limiti dello studio
In alcuni preparati atriali umani, APD non rimane stabile durante la superfusione prolungata con soluzioni saline (in genere, ~ 2 h).-La classificazione dei pazienti in SR e AF può non essere sempre affidabile, cioè, il gruppo SR può includere tessuto atriale da pazienti che hanno avuto episodi non riconosciuti di AF parossistica o di recente insorgenza.
Conclusione
In sintesi, il bloccante IKur MK-0448 eleva costantemente il plateau del potenziale d’azione nelle trabecole atriali umane indipendentemente dalle forme iniziali dei potenziali d’azione di controllo e se i preparati sono stati ottenuti da pazienti in SR o AF permanente. Nelle preparazioni SR, MK-0448 ha prodotto un accorciamento dell’APD90 e dell’ERP, ma nel tessuto della FA permanente, sono stati osservati effetti prominenti di allungamento dell’APD90 e dell’ERP con il farmaco. Per la prevenzione della recidiva di FA persistente, il prolungamento di ERP da MK-0448 nelle preparazioni di FA è certamente una modalità di azione altamente auspicabile che può proteggere il miocardio atriale durante la fase di rimodellamento inverso dopo la cardioversione, anche se se a causa della modulazione IKs questo può venire ad un rischio di indurre proaritmia ventricolare. Resta da determinare se i farmaci IKur selettivi (i) sono più efficaci nel prolungare l’ERP a tassi atriali più elevati, (ii) convertire farmacologicamente la FA di recente insorgenza, (iii) ridurre il carico di FA nella FA parossistica e (iv) prevenire la ricorrenza della FA persistente.
Dichiarazione di conflitto di interessi
James Milnes e John Ford sono dipendenti della Xention Ltd., John Ford è co-fondatore e detiene azioni della Xention Ltd., Ursula Ravens ha agito come consulente della Xention. Simone Loose, Judith Mueller, Michael Knaut, Erich Wettwer non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano il supporto finanziario dell’Unione Europea (FP7-Health T2-2010-261057 “EUTRAF”) e Xention Limited. Desideriamo ringraziare tutti i pazienti e i cardiochirurghi Klaus Matschke e Michael Knaut per il loro prezioso supporto, e Konstanze Fischer per la sua esperta assistenza tecnica.
Amos, G. J., Wettwer, E., Metzger, F., Li, Q., Himmel, H. M., e Ravens, U. (1996). Differenze tra le correnti verso l’esterno di miociti atriali umani e ventricolari subepicardici. J. Physiol. 491(Pt 1), 31-50.
Pubmed Abstract | Pubmed Full Text
Attuel, P., Childers, R., Cauchemez, B., Poveda, J., Mugica, J., e Coumel, P. (1982). Fallimento nell’adattamento del tasso del periodo refrattario atriale: il suo rapporto con la vulnerabilità. Int. J. Cardiol. 2, 179-197. doi: 10.1016/0167-5273(82)90032-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christ, T., Wettwer, E., Voigt, N., Hala, O., Radicke, S., Matschke, K., et al. Patologia-specifici effetti del bloccante I(Kur)/I(to)/I(K,ACh) AVE0118 sui canali ionici nella fibrillazione atriale cronica umana. Br. J. Pharmacol. 154, 1619-1630. doi: 10.1038/bjp.2008.209
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christophersen, I. E., Olesen, M. S., Liang, B., Andersen, M. N., Larsen, A. P., Nielsen, J. B., et al. Variazione genetica in KCNA5: impatto sulla corrente di potassio atriale-specifica IKur in pazienti con fibrillazione atriale solitaria. Eur. Heart J. 34, 1517-1525. doi: 10.1093/eurheartj/ehs442
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Daoud, E. G., Bogun, F., Goyal, R., Harvey, M., Man, K. C., Strickberger, S. A., et al. Effetto della fibrillazione atriale sulla refrattarietà atriale nell’uomo. Circulation 94, 1600-1606. doi: 10.1161/01.CIR.94.7.1600
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dobrev, D., and Ravens, U. (2003). Rimodellamento dei canali ionici dei cardiomiociti nella fibrillazione atriale umana. Basic Res. Cardiol. 98, 137-148. doi: 10.1007/s00395-003-0409-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J., Milnes, J., Wettwer, E., Christ, T., Rogers, M., Sutton, K., et al. Proprietà elettrofisiologiche e farmacologiche umane di XEN-D0101: un nuovo inibitore atriale selettivo Kv1.5/IKur. J. Cardiovasc. Pharmacol. 61, 408-415. doi: 10.1097/FJC.0b013e31828780eb
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J. W., and Milnes, J. T. (2008). Nuovi farmaci che hanno come obiettivo la corrente cardiaca ultra-rapida ritardata rettificatrice (I Kur): logica, farmacologia e prove di potenziale valore terapeutico. J. Cardiovasc. Pharmacol. 52, 105-120. doi: 10.1097/FJC.0b013e3181719b0c
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franz, M. R., Karasik, P. L., Li, C., Moubarak, J., and Chavez, M. (1997). Rimodellamento elettrico dell’atrio umano: effetti simili in pazienti con fibrillazione atriale cronica e flutter atriale. J. Am. Coll. Cardiol. 30, 1785-1792. doi: 10.1016/S0735-1097(97)00385-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gintant, G. A. (2000). Caratterizzazione e conseguenze funzionali del transiente di corrente del raddrizzatore ritardato nella ripolarizzazione ventricolare. Am. J. Physiol. Heart Circ. Physiol. 278, H806-H817.
Pubmed Abstract | Pubmed Full Text
Haissaguerre, M., Jais, P., Shah, D. C., Takahashi, A., Hocini, M., Quiniou, G., et al. Inizio spontaneo della fibrillazione atriale da battiti ectopici che hanno origine nelle vene polmonari. N. Engl. J. Med. 339, 659-666. doi: 10.1056/NEJM199809033391003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lynch, J. J. Jr., Houle, M. S., Stump, G. L., Wallace, A. A., Gilberto, D. B., Jahansouz, H., et al. (1999). Efficacia antiaritmica del blocco selettivo della corrente ritardante di attivazione cardiaca lentamente, I(Ks), in modelli canini di aritmia ventricolare ischemica maligna. Circulation 100, 1917-1922. doi: 10.1161/01.CIR.100.18.1917
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mays, D. J., Foose, J. M., Philipson, L. H., and Tamkun, M. M. (1995). Localizzazione della proteina del canale Kv1.5 K+ nel tessuto cardiaco espiantato. J. Clin. Invest. 96, 282-292. doi: 10.1172/JCI118032
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Olson, T. M., Alekseev, A. E., Liu, X. K., Park, S., Zingman, L. V., Bienengraeber, M., et al. Kv1.5 channelopathy a causa di KCNA5 perdita di funzione mutazione causa fibrillazione atriale umana. Hum. Mol. Genet. 15, 2185-2191. doi: 10.1093/hmg/ddl143
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pavri, B. B., Greenberg, H. E., Kraft, W. K., Lazarus, N., Lynch, J. J., Salata, J. J., et al. MK-0448, un inibitore specifico di Kv1.5: sicurezza, farmacocinetica ed elettrofisiologia farmacodinamica in modelli animali sperimentali e nell’uomo. Circ. Arrhythm. Electrophysiol. 5, 1193-1201. doi: 10.1161/CIRCEP.111.969782
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Radicke, S., Cotella, D., Graf, E. M., Banse, U., Jost, N., Varro, A., et al. Modulazione funzionale della corrente transitoria verso l’esterno Ito da KCNE beta-subunità e la distribuzione regionale in umano non-failing e cuori in crisi. Cardiovasc. Res, 71, 695-703. doi: 10.1016/j.cardiores.2006.06.017
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U. (2010). Terapia antiaritmica nella fibrillazione atriale. Pharmacol. Ther. 128, 129-145. doi: 10.1016/j.pharmthera.2010.06.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U., and Wettwer, E. (2011). Canali rettificatori ritardati ultra-rapidi: basi molecolari e implicazioni terapeutiche. Cardiovasc. Res. 89, 776-785. doi: 10.1093/cvr/cvq398
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Regan, C. P., Wallace, A. A., Cresswell, H. K., Atkins, C. L., and Lynch, J. J. Jr. Effetti elettrofisiologici in vivo di un nuovo bloccante IKur dell’ossido di difenilfosfina, (2-Isopropyl-5-methylcyclohexyl) ossido di difenilfosfina, nel ratto e nel primate non umano. J. Pharmacol. Exp. Ther. 316, 727-732. doi: 10.1124/jpet.105.094839
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Snyders, D. J., Tamkun, M. M., and Bennett, P. B. (1993). Un canale di potassio rapidamente attivante e lentamente inattivante clonato dal cuore umano. Analisi funzionale dopo l’espressione in coltura stabile di cellule di mammifero. J. Gen. Physiol. 101, 513-543. doi: 10.1085/jgp.101.4.513
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tamargo, J., Caballero, R., Gomez, R., and Delpon, E. (2009). Bloccanti dei canali I(Kur)/Kv1.5 per il trattamento della fibrillazione atriale. Expert Opin. Investig. Drugs 18, 399-416. doi: 10.1517/13543780902762850
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, Z., Fermini, B., and Nattel, S. (1993). Corrente in uscita indotta da depolarizzazione sostenuta in miociti atriali umani. Prove per un nuovo raddrizzatore ritardato K + corrente simile a Kv1.5 correnti di canale clonato. Circ. Res. 73, 1061-1076. doi: 10.1161/01.RES.73.6.1061
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wettwer, E., Hala, O., Christ, T., Heubach, J. F., Dobrev, D., Knaut, M., et al. Ruolo di IKur nel controllo della forma del potenziale d’azione e della contrattilità nell’atrio umano: influenza della fibrillazione atriale cronica. Circulation 110, 2299-2306. doi: 10.1161/01.CIR.0000145155.60288.71
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text