di Alyssa Cecchetelli e Lukas Morgan
Gli organismi modello sono strumenti vitali usati dai ricercatori di tutto il mondo. Questi organismi condividono molti geni con gli esseri umani, sono facilmente mantenuti in laboratorio e hanno tempi di generazione brevi che rendono facile studiare gli effetti delle manipolazioni genetiche. In questo post del blog, copriremo cinque organismi modello popolari, ma ce ne sono molti altri là fuori.
Il topo domestico (Mus musculus)
 Iniziamo con l’organismo modello mammifero preferito da molti ricercatori: il topo (Mus musculus). I topi hanno molti vantaggi come mammiferi modello per gli scienziati in quanto hanno un tempo di generazione relativamente breve per i mammiferi – il tempo tra la nascita e il parto – di circa 10 settimane. I topi adulti si riproducono ogni tre settimane, così gli scienziati possono osservare simultaneamente diverse generazioni di topi alla volta.
Iniziamo con l’organismo modello mammifero preferito da molti ricercatori: il topo (Mus musculus). I topi hanno molti vantaggi come mammiferi modello per gli scienziati in quanto hanno un tempo di generazione relativamente breve per i mammiferi – il tempo tra la nascita e il parto – di circa 10 settimane. I topi adulti si riproducono ogni tre settimane, così gli scienziati possono osservare simultaneamente diverse generazioni di topi alla volta.
Perché i topi sono geneticamente e fisiologicamente più simili agli umani di molti altri organismi modello, sono spesso usati per studiare le malattie umane. Le malattie nei topi mostrano molti fenotipi simili alle malattie umane e hanno aiutato con successo i ricercatori a sviluppare una varietà di terapie. Per esempio, molti scienziati usano i topi per studiare malattie come il cancro, poiché i topi ricapitolano meglio le complesse interazioni tra le cellule tumorali, i farmaci terapeutici e il resto del corpo rispetto agli studi in altri organismi modello o alla cultura cellulare. Per esempio, il laboratorio di Scott Lowe ha utilizzato i topi per studiare come le diverse mutazioni nella leucemia impattano sui diversi regimi di trattamento (Zuber et al., 2009). Iniettando nei topi vettori retrovirali che contengono diverse mutazioni che si trovano nella leucemia, il laboratorio di Lowe è stato in grado di identificare una serie di mutazioni che rendono le cellule tumorali più resistenti alla chemioterapia. Potete trovare questi plasmidi su Addgene.
Un altro vantaggio dei topi come organismi modello è che sono geneticamente trattabili. I topi possono essere facilmente manipolati con strumenti come CRISPR per creare linee transgeniche.
Il moscerino della frutta (Drosophila melanogaster)
 Un altro popolare organismo modello è Drosophila melanogaster, o come è più comunemente conosciuto: il moscerino della frutta. Il moscerino della frutta è stato usato nella ricerca scientifica per oltre un secolo, ma è stato portato alla ribalta da Thomas Hunt Morgan, che è conosciuto come il “padre” della ricerca sulla Drosophila. Morgan scoprì che i geni si trovavano all’interno dei cromosomi usando il moscerino della frutta molto prima che noi sapessimo che il DNA era materiale genetico (Jennings, 2011).
Un altro popolare organismo modello è Drosophila melanogaster, o come è più comunemente conosciuto: il moscerino della frutta. Il moscerino della frutta è stato usato nella ricerca scientifica per oltre un secolo, ma è stato portato alla ribalta da Thomas Hunt Morgan, che è conosciuto come il “padre” della ricerca sulla Drosophila. Morgan scoprì che i geni si trovavano all’interno dei cromosomi usando il moscerino della frutta molto prima che noi sapessimo che il DNA era materiale genetico (Jennings, 2011).
Il moscerino della frutta è un ottimo organismo modello perché è facile ed economico da coltivare e mantenere in laboratorio, ha un breve ciclo di vita da 8 a 14 giorni, e produce un gran numero di figli che vengono deposti all’esterno. I moscerini della frutta sono anche relativamente semplici da manipolare geneticamente. Gli scienziati possono creare una nuova linea di mosche in sole 6 settimane rispetto ai mesi necessari per creare una linea transgenica di topo. Nel corso degli anni il moscerino è diventato un organismo modello ideale per studiare una serie di argomenti tra cui lo sviluppo, la genetica e il sistema nervoso. Il moscerino è anche emerso come un importante modello di malattia umana con un potenziale per la scoperta di farmaci terapeutici, in quanto si stima che il 75% dei geni che causano malattie negli esseri umani hanno un omologo funzionale nella mosca (Pandey e Nichols, 2011).
Un enorme vantaggio di utilizzare il moscerino della frutta è la serie di strumenti genetici, come il sistema GAL4/UAS e LexA, che permette agli scienziati di controllare facilmente il livello e l’espressione spazio-temporale di un gene di interesse. Questo tipo di controllo sull’espressione genica è possibile in altri sistemi modello, ma può essere piuttosto difficile e richiedere tempo. GAL4/UAS è stato descritto per la prima volta nel 1993 dal laboratorio di Norbert Perrimon ed è stato continuamente migliorato da allora. Se sei interessato a questi sistemi controlla il laboratorio di Gerald Rubin che ha creato una serie di vettori modulari che possono essere utilizzati per controllare in modo ottimale l’espressione genica in cellule specifiche della mosca (Pfeiffer et al., 2010).
Yeast (Saccharomyces cerevisiae)
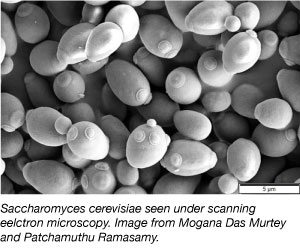 Yeast, uno dei più semplici organismi eucarioti, è un organismo modello comunemente usato nella ricerca scientifica. Sì, lo stesso tipo che usiamo nel pane e in altri prodotti da forno! Il lievito è economico, semplice e facile da lavorare perché può sopravvivere in una varietà di condizioni ambientali, e raddoppia ogni 2 ore. Il lievito è anche il primo genoma eucariotico ad essere interamente sequenziato ed è molto adatto alla manipolazione genetica.
Yeast, uno dei più semplici organismi eucarioti, è un organismo modello comunemente usato nella ricerca scientifica. Sì, lo stesso tipo che usiamo nel pane e in altri prodotti da forno! Il lievito è economico, semplice e facile da lavorare perché può sopravvivere in una varietà di condizioni ambientali, e raddoppia ogni 2 ore. Il lievito è anche il primo genoma eucariotico ad essere interamente sequenziato ed è molto adatto alla manipolazione genetica.
Le cellule di lievito sono un ottimo organismo modello non solo per le ragioni di cui sopra, ma perché condividono effettivamente molte proprietà e processi biologici con le nostre cellule. Come le cellule umane, il DNA del lievito è impacchettato in cromosomi e circa il 23% dei geni del lievito hanno una controparte negli esseri umani (Liu et al., 2017). Così il lievito può essere utilizzato per studiare la base molecolare delle malattie umane che sono causate da un gene specifico. Per esempio, diversi geni mutati nei tumori umani hanno un omologo coinvolto nella divisione cellulare del lievito (Pray, 2008). Le scoperte scientifiche nel lievito possono poi essere ulteriormente studiate in altri organismi modello che meglio ricapitolano le condizioni in vivo simili a quelle umane.
Per esempio, a causa della loro semplicità, il lievito è diventato un importante modello sperimentale nello studio delle malattie neurologiche, come il morbo di Parkinson (PD). Il morbo di Parkinson è caratterizzato principalmente dal misfolding delle proteine che porta ad un accumulo di aggregati proteici chiamati “corpi di lewy” nel cervello. I modelli di lievito di PD, come quelli che sovraesprimono la proteina tossica α-sinucleina (la proteina più comune trovata nei corpi di lewy), sono stati inestimabili nella comprensione dei meccanismi molecolari di base alla base della malattia (Menezes et al., 2015). Poiché i lieviti sono organismi unicellulari, possono anche essere utilizzati per screenare facilmente più composti terapeutici in un unico esperimento.
Zebrafish (Danio rerio)
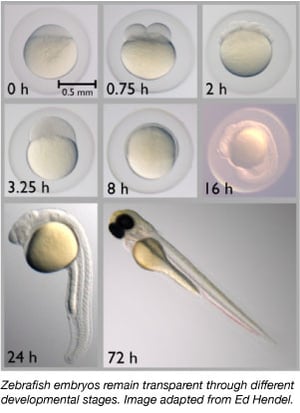 Dagli anni ’60, il pesce zebra è diventato gradualmente un importante organismo modello. Condividono circa il 70% dei loro geni con gli esseri umani e l’85% dei geni umani associati a una malattia hanno un omologo nel pesce zebra (Howe et al., 2013). Gli zebrafish sono piccoli, facilmente mantenuti in quanto sono alloggiati in grandi gruppi, facilmente allevati, e producono 50-300 uova alla volta. Gli embrioni di zebrafish sono anche deposti e fecondati esternamente, permettendo agli scienziati di manipolarli facilmente. Gli scienziati possono semplicemente iniettare embrioni unicellulari con DNA o RNA per modificare i loro genomi o per creare animali transgenici.
Dagli anni ’60, il pesce zebra è diventato gradualmente un importante organismo modello. Condividono circa il 70% dei loro geni con gli esseri umani e l’85% dei geni umani associati a una malattia hanno un omologo nel pesce zebra (Howe et al., 2013). Gli zebrafish sono piccoli, facilmente mantenuti in quanto sono alloggiati in grandi gruppi, facilmente allevati, e producono 50-300 uova alla volta. Gli embrioni di zebrafish sono anche deposti e fecondati esternamente, permettendo agli scienziati di manipolarli facilmente. Gli scienziati possono semplicemente iniettare embrioni unicellulari con DNA o RNA per modificare i loro genomi o per creare animali transgenici.
I pesci zebra sono un organismo modello ideale per gli studi sullo sviluppo embrionale perché i loro embrioni sono completamente trasparenti. Così gli scienziati possono facilmente osservare le prime fasi di sviluppo che possono essere difficili in altre specie di vertebrati. La trasparenza permette anche agli scienziati di osservare facilmente le proteine e i tessuti etichettati con la fluorescenza per valutare meglio i processi di sviluppo.
Per esempio, il laboratorio Stainier ha studiato la proliferazione e la differenziazione delle cellule β nel pancreas del pesce zebra in via di sviluppo. Hanno prima etichettato queste cellule usando plasmidi. Poi usando HOTcre, un metodo che utilizza l’induzione del calore per controllare l’espressione temporale di diversi transgeni, il gruppo Stainer ha determinato che ci sono in realtà due popolazioni distinte di β-cellule che hanno origine in diverse regioni del pancreas e producono diversi livelli di insulina (Hesselson et al., 2009).
Il verme (Caenorhabditis elegans)
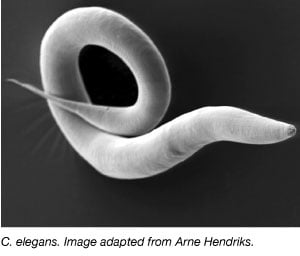 Il verme, Caenorhabditis elegans, è stato ampiamente utilizzato come organismo modello dagli anni ’70 quando Sydney Brenner lo portò in laboratorio per studiare lo sviluppo neuronale (Brenner, 1973). I C. elegans sono vermi piccoli e trasparenti che hanno un ciclo di vita rapido e grandi dimensioni della covata. La maggior parte dei C. elegans sono anche ermafroditi autofertili, il che rende facile condurre grandi esperimenti su più generazioni. Similmente ad altri organismi modello, il genoma di C. elegans è anche completamente sequenziato e più del 60% dei geni umani hanno un ortologa in C. elegans rendendolo ideale per studiare i processi di biologia molecolare di base.
Il verme, Caenorhabditis elegans, è stato ampiamente utilizzato come organismo modello dagli anni ’70 quando Sydney Brenner lo portò in laboratorio per studiare lo sviluppo neuronale (Brenner, 1973). I C. elegans sono vermi piccoli e trasparenti che hanno un ciclo di vita rapido e grandi dimensioni della covata. La maggior parte dei C. elegans sono anche ermafroditi autofertili, il che rende facile condurre grandi esperimenti su più generazioni. Similmente ad altri organismi modello, il genoma di C. elegans è anche completamente sequenziato e più del 60% dei geni umani hanno un ortologa in C. elegans rendendolo ideale per studiare i processi di biologia molecolare di base.
C. elegans sono anche abbastanza adatti alla manipolazione genetica. Gli animali transgenici possono essere creati semplicemente micro-iniettando DNA nel verme, come gli animali che esprimono marcatori fluorescenti (Mello et al., 1991). I geni possono anche essere facilmente abbattuti attraverso l’interferenza dell’RNA (RNAi) alimentando il verme con batteri che esprimono plasmidi specifici (L4440) che contengono il gene di interesse (Fire et al., 1998). La scoperta dell’RNAi nel verme ha effettivamente premiato i depositari Andrew Fire e Craig Mello con un premio Nobel nel 2006.
Uno dei maggiori vantaggi dei C. elegans è che sono trasparenti per tutta la loro vita. Così qualsiasi modifica genetica, come l’espressione della proteina fluorescente o l’interruzione di un gene, può essere facilmente visualizzata in un organismo vivente dallo sviluppo embrionale all’età adulta. Questa capacità di manipolare geneticamente e visualizzare cellule e tessuti permette agli scienziati di condurre studi in vivo che possono essere piuttosto difficili in altri organismi modello. I vermi sono stati utilizzati per indagare una serie di sistemi e processi biologici tra cui il sistema nervoso, lo sviluppo, la segnalazione cellulare, l’invecchiamento e la meccanotrasduzione per citarne alcuni. Per esempio, il laboratorio di Andrew Leifer ha utilizzato il verme per studiare la segnalazione del calcio nell’intero cervello adulto, utilizzando un plasmide che esprime un sensore di calcio geneticamente codificato, GCaMP6 (Nguyen et al., 2015). Se siete interessati a C. elegans plasmidi e risorse controllare Addgene’s Worm Expression pagina.
Cercando più organismi modello? Dai un’occhiata alla seconda parte della famosa serie sugli organismi modello, e leggi i nuovi sistemi in fase di sviluppo per gli organismi modello emergenti!
Brenner, Sydney. “La genetica di Caenorhabditis elegans”. Genetica 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. “Popolazioni distinte di quiescenti e proliferative β-cellule pancreatiche identificati da HOTcre mediata etichettatura.” Atti della National Academy of Sciences 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. “La sequenza del genoma di riferimento zebrafish e la sua relazione con il genoma umano.” Natura496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. “Drosophila-a versatile modello in biologia & medicina.” Materiali oggi 14.5 (2011): 190-195.
Mello, Craig C., et al. “Trasferimento genico efficiente in C. elegans: mantenimento extracromosomico e integrazione di sequenze di trasformazione”. La rivista EMBO 10.12 (1991): 3959-3970. PubMed PMID: 1935914. PubMed Central PMCID: PMC453137.
Nguyen, Jeffrey P., et al. “Whole-brain calcium imaging con risoluzione cellulare in Caenorhabditis elegans comportamento libero”. Atti della National Academy of Sciences 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan, e Charles D. Nichols. “Modelli di malattie umane in Drosophila melanogaster e il ruolo della mosca nella scoperta di farmaci terapeutici”. Recensioni farmacologiche 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.