Atomi e oro
Nel 1911, Rutherford e i suoi collaboratori Hans Geiger ed Ernest Marsden iniziarono una serie di esperimenti rivoluzionari che avrebbero cambiato completamente il modello accettato dell’atomo. Bombardarono fogli d’oro molto sottili con particelle alfa in rapido movimento.

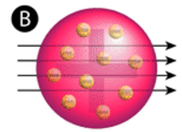

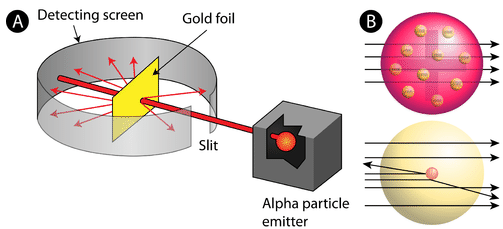
Figura \(\PageIndex{2}}) (A) La configurazione sperimentale dell’esperimento di Rutherford con la lamina d’oro: Un elemento radioattivo che emetteva particelle alfa era diretto verso un sottile foglio d’oro che era circondato da uno schermo che avrebbe permesso di rilevare le particelle deviate. (B) Secondo il modello del budino di prugne (in alto) tutte le particelle alfa avrebbero dovuto passare attraverso il foglio d’oro con poca o nessuna deviazione. Rutherford trovò che una piccola percentuale di particelle alfa veniva deviata con grandi angoli, il che potrebbe essere spiegato da un atomo con un nucleo molto piccolo, denso e caricato positivamente al suo centro (in basso).
Secondo il modello atomico accettato, in cui la massa e la carica di un atomo sono distribuite uniformemente in tutto l’atomo, gli scienziati si aspettavano che tutte le particelle alfa sarebbero passate attraverso la lamina d’oro con solo una leggera deviazione o nessuna. Sorprendentemente, come mostrato nella figura 2, mentre la maggior parte delle particelle alfa erano effettivamente senza deflessione, una piccolissima percentuale (circa 1 su 8000 particelle) rimbalzava sulla lamina d’oro con angoli molto grandi. Alcune furono persino reindirizzate verso la sorgente. Nessuna conoscenza precedente li aveva preparati a questa scoperta. In una famosa citazione, Rutherford esclamò che era “come se tu avessi sparato un proiettile di 15 pollici contro un pezzo di tessuto e questo fosse tornato indietro e ti avesse colpito”
Rutherford doveva inventare un modello completamente nuovo dell’atomo per spiegare i suoi risultati. Poiché la stragrande maggioranza delle particelle alfa era passata attraverso l’oro, ragionò che la maggior parte dell’atomo era uno spazio vuoto. Al contrario, le particelle che erano state altamente deviate dovevano aver sperimentato una forza tremendamente potente all’interno dell’atomo. Concluse che tutta la carica positiva e la maggior parte della massa dell’atomo dovevano essere concentrate in uno spazio molto piccolo all’interno dell’atomo, che chiamò nucleo. Il nucleo è il piccolo e denso nucleo centrale dell’atomo ed è composto da protoni e neutroni.
Il modello atomico di Rutherford divenne noto come modello nucleare. Nell’atomo nucleare, i protoni e i neutroni, che comprendono quasi tutta la massa dell’atomo, si trovano nel nucleo al centro dell’atomo. Gli elettroni sono distribuiti intorno al nucleo e occupano la maggior parte del volume dell’atomo. Vale la pena sottolineare quanto sia piccolo il nucleo rispetto al resto dell’atomo. Se potessimo gonfiare un atomo fino a farlo diventare delle dimensioni di un grande stadio di calcio professionale, il nucleo avrebbe circa le dimensioni di una biglia.
Il modello di Rutherford si rivelò un passo importante verso una piena comprensione dell’atomo. Tuttavia, non affrontava completamente la natura degli elettroni e il modo in cui occupavano il vasto spazio intorno al nucleo. Per questa e altre intuizioni, Rutherford ricevette il premio Nobel per la chimica nel 1908. Sfortunatamente, Rutherford avrebbe preferito ricevere il Premio Nobel per la Fisica perché considerava la fisica superiore alla chimica. Secondo lui, “Tutta la scienza è o fisica o collezionismo di francobolli”
.