A molekuláris geometria, polaritás és más hasonló tulajdonságok megértéséhez ismernünk kell az adott vegyület néhány alapvető tulajdonságát és Lewis-szerkezetét. Az SF4 a kén-tetrafluorid kémiai képlete. Ez egy színtelen, maró hatású gáz, amelyet számos szerves fluorvegyület szintézisében használnak. Az SF4 meglehetősen veszélyes vegyület, de a vegyipari és gyógyszeripari vállalatok széles körben használják.
| Molekula neve | Kén-tetrafluorid ( SF4) |
| Valenciaelektronok száma a molekulában | 34 |
| SF4 hibridizációja | sp3 Hibridizáció |
| kötésszögek | 102 fok és 173 fok |
| A SF4 molekulageometriája | Trigonális bipiramis |
A molekula tulajdonságainak megértéséhez, mint például a reakcióképességét, polaritását és egyebeket, először is ismernünk kell az SF4 Lewis-szerkezetét.
Tartalom
SF4 molekuláris geometria
Egy adott molekula molekuláris geometriáját könnyen megérthetjük a molekuláris képlet vagy a VSEPR modell segítségével. A molekuláris képlet segít megismerni az adott vegyületben jelen lévő atomok pontos számát és típusát. Itt egy kénatom és négy fluoratom van a vegyületben, ami hasonlóvá teszi azt az AX4E molekuláris képletéhez.
Az AX4E molekulaformulával rendelkező molekulák trigonális bipiramis molekulageometriával rendelkeznek. Itt a kénatomhoz kötést alkotó két fluoratom az egyenlítői pozíciókban, a maradék kettő pedig az axiális pozíciókban helyezkedik el. Mivel a központi atomon egy magányos pár van, ez taszítja a kötő elektronpárt, ami egy kissé elferdíti az alakot, és lengőhinta-szerűvé teszi azt. Az elektronok ezt az elrendeződési mintát követik a VSEPR-szabályt követve, hogy minimalizálják a magányos elektronpárok közötti taszítóerőket a molekula stabilitásának maximalizálása érdekében.
Az SF4 tehát trigonális bipiramis molekulageometriával rendelkezik.
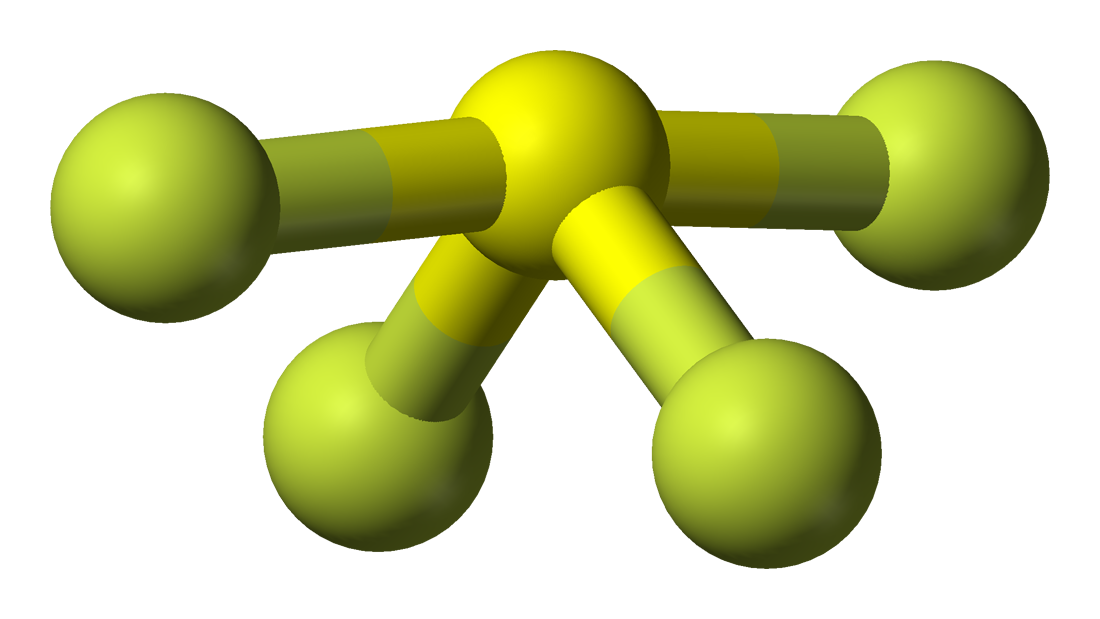
SF4 Lewis-szerkezet
A Lewis-szerkezet a molekulában lévő kötések és valenciaelektronok képi ábrázolása. A két atom között kialakult kötéseket vonalakkal, míg a kötést nem alkotó valenciaelektronokat pontokkal ábrázoljuk. A kötések kialakításában részt vevő valenciaelektronokat kötő elektronpároknak nevezzük, míg a kötésben részt nem vevő és kötést nem kialakító elektronokat nem kötő elektronpároknak vagy magányos elektronpároknak.
Az SF4 Lewis-szerkezetének megrajzolásához először is ismernünk kell a molekula összes valenciaelektronjainak számát.
Amint valószínűleg láthatjuk, ebben a vegyületben egy kénatom és négy fluoratom van. Ahhoz, hogy megismerjük ennek a vegyületnek az összes valenciaelektronját, ismernünk kell mindkét atom valenciaelektronjait külön-külön.
- A kén valenciaelektronjai: 6
- A fluor valenciaelektronjai: (7)
( mivel négy fluoratom van, az összes atom valenciaelektronjait figyelembe kell vennünk)
SF4 összes valenciaelektronjainak száma = a kén valenciaelektronjainak száma + a fluor valenciaelektronjainak száma
= 6 + 28
= 34 valenciaelektron
Most már tudjuk az összes valenciaelektron számát, könnyen megérthetjük az atomok közötti kötésképzést és a molekula teljes elrendeződését is.
A kén lesz a központi atom ebben a molekulában, mivel ez a legkevésbé elektronegatív, a központi atom oldalain pedig négy fluoratom képez kötéseket. Minden fluoratom kötést fog kialakítani a központi atomhoz, ami azt jelenti, hogy a molekula szerkezetében négy kötés lesz, felhasználva a fluoratomok négy valenciaelektronját és a kénatom 4 elektronját. Így most nyolc valenciaelektron kerül felhasználásra, ami 34-ről 24-re csökkenti a valenciaelektronok számát. Az összes fluoratomnak hat valenciaelektronja van, a központi atomnak pedig két valenciaelektronja.
A kötések jelölésére húzzunk vonalakat az S és F között, a magányos elektronpárokat pedig pontokkal jelezzük. Minden fluoratomon három pár 6 valenciaelektron ( pontokként ábrázolva) lesz az atomon, valamint egy kötés a kénnel. Ezzel szemben a központi atomnak két valenciaelektronja és négy kötése lesz.
Az SF4 Lewis-szerkezetében tehát a központi atom, a kén egy magányos elektronpárral és négy kötéses elektronpárral rendelkezik. Ugyanakkor minden egyes fluoratomnak három magányos párja lesz.
Az SF4 poláris?
Mihelyt ismerjük az adott vegyület Lewis-szerkezetét és molekulageometriáját, könnyebbé válik a molekula polaritásának ábrázolása. Itt egy magányos pár a központi kénatomon és négy kötő elektronpár vezet az elektronok aszimmetrikus eloszlásához a központi atomon.
Amint a molekula alakja olyan, mint egy lengőteke, két fluoratom ki tudja egyenlíteni egymás dipólusmomentumát, de a többi kettő az elektronok elrendeződése miatt nem. És mivel a fluoratomok elektronegatívabbak, mint a kénatomok, ez a töltés egyenetlen eloszlását eredményezi. Ezért a dipólusmomentum nem szűnik meg, ami a molekulát polárissá teszi. Tehát igen, az SF4 poláris.
SF4 hibridizáció
Az SF4 molekula hibridizációjának megismeréséhez először nézzük meg a központi atom elektronsűrűségének régióit.
A kénnek négy kötő elektronpárja és egy magányos elektronpárja van, így az elektronsűrűség régióinak száma összesen öt. A kénatom tehát öt hibridizált orbitált használ, egy 3s orbitált, három 3p orbitált és egy 3d orbitált. Az elektronoknak ez az elrendezése az atom körül és a hibridizált pályáknak az sp3d hibridizációhoz vezet. A hibridizáció megismeréséhez a sztérikus számot is használhatjuk; itt a kénatom esetében a sztérikus szám 5.
Az SF4 tehát sp3d hibridizációval rendelkezik.
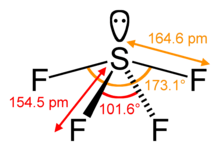
SF4 Kötésszögek és alak
A központi kénatom négy kötést képez a szomszédos fluoratomokkal, és egy magányos elektronpárral rendelkezik. Az egyenlítői pozíciókban lévő fluoratomok kötésszöge 102 fokos, az axiálisaké 173 fokos, ami kissé eltér a trigonális bipiramis molekulageometriától, ami lengő alakot eredményez.
A központi atomon lévő magányos pár miatt az egyenlítői fluoratomok kötésszögei 120 fokról 102 fokra, az axiális fluoratomoké pedig 180 fok helyett 173 fokra változnak.
Következtető megjegyzések
A tulajdonságok összegzéseként elmondhatjuk,
- A kén-tetrafluoridnak 34 valenciaelektronja van, amelyből négy kovalens kötést és egy magányos elektronpárt képez a központi atomon a Lewis szerkezetében.
- Minden egyes fluoratomon három magányos pár található.
- A molekuláris geometriája AX4E képletű; lengőteke alakot alkot és trigonális bipiramis molekuláris geometriával rendelkezik.
- Az SF4 sp3d hibridizációval rendelkezik és poláris természetű.