A neprilizin a kardiológia érdeklődésének középpontjába került, mivel a neprilizin-gátlás és az angiotenzinreceptor-blokád kombinációjának lenyűgöző előnyeit a közelmúltban végzett PARADIGM-HF vizsgálat bizonyította, amely az LCZ696-ot (jelenleg sacubitril/valsartan néven ismert és a Novartis által Entresto néven forgalmazott) tesztelte a csökkent ejekciós frakciójú szisztolés szívelégtelenség (HFrEF) kezelésére.1 A neprilizin EC 3.4.24.11 (más néven semleges endopeptidáz, endoproteáz 24.11, NEP, közös akut limfoblasztos leukémia antigén , neutrofil antigén klaszter differenciációs antigén 10 , membrán metalloendopeptidáz EC 3.4.24.11 és enkefalináz) azonban egy rendkívül sokoldalú enzim, amely egy > 40 éves mozgalmas karrier után ismét reflektorfénybe került.2
A kardiovaszkuláris rendszerben a neprilizin számos vasoaktív peptidet hasít. E peptidek némelyike értágító hatású (többek között a natriuretikus peptidek, az adrenomedullin és a bradikinin), mások pedig érösszehúzó hatásúak (többek között az angiotenzin I és II, valamint az endotelin-1). Mindazonáltal a neprilizin különböző relatív affinitást mutat a különböző szubsztrátok között; a legnagyobb affinitása a pitvari natriuretikus peptidhez, a C-típusú natriuretikus peptidhez és az I. és II. angiotenzinhez van; a legkisebb affinitása a B-típusú natriuretikus peptidhez (BNP), az endotelin-1-hez és a bradikininhez.3
A neprilizin évtizedek óta fontos biotarget. Az akadémiai és az ipari szféra közös aktív erőfeszítéseket tesz a klinikai gyakorlatban hasznosnak bizonyuló neprilizin-inhibitorok (NEPI-k) keresésére. Kezdetben, az 1980-as évek végén és az 1990-es évek elején NEPI-monoterápiát teszteltek. A candoxatril ígéretes előzetes hatást mutatott a hemodinamikai paraméterekre. Egy másik NEPI, az ecadotril azonban szívelégtelenségben szenvedő betegeknél magasabb mortalitást eredményezett, és nem volt bizonyíték a klinikai hatékonyságra a placebóval összehasonlítva.4,5 Következésképpen a szívelégtelenségben alkalmazott NEPI-monoterápia fejlesztését leállították. Ezt követően néhány vizsgálat a renin-angiotenzin-aldoszteron rendszer egyidejű aktiválódásának bizonyítékát mutatta ki, a natriuretikus peptidek bioaktivitásának fokozódásával együtt. Ezek az eredmények inspirálták a NEPI-t és az angiotenzin-konvertáló enzim gátló (ACEI) aktivitást kombináló szerek kifejlesztését és tesztelését, ami a vasopeptidáz-gátlóként ismert gyógyszerekhez vezetett. Számos vasopeptidáz-gátlót fejlesztettek ki, köztük az omapatrilátot, a fasidotrilt, a sampatrilátot és a mixanprilt. Számos vizsgálat után a szakma nagy csalódással tapasztalta, hogy az omapatrilat egyre több klinikailag releváns angioödéma epizódot idézett elő.6 Több mint egy évtizedes sivatagi bolyongás után új koncepciót dolgoztak ki, a NEPI és az angiotenzin II receptor blokkolók (ARB-k) kombinációját, amely az angiotenzin receptor neprilizin gátlóknak nevezett új gyógyszercsoporthoz vezetett. A sacubitril/valsartan egy első osztályú angiotenzinreceptor-neprilysin-gátló, amely a PARADIGM-HF vizsgálatban1 a vártnál jobb eredményeket mutatott (ábra).
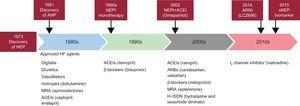
A történeti neprilizin kiemelések sematikus ábrája. ACEI, angiotenzin-konvertáló enzim gátló; ANP, pitvari natriuretikus peptid; ARB, angiotenzin II receptor blokkoló; ARNI, angiotenzin receptor neprilizin inhibitor; HF, szívelégtelenség; MRA, mineralokortikoid receptor antagonista; NEP, neprilizin; NEPI, neprilizin inhibitor; sNEP, oldható neprilizin.
A PARADIGM-HF egy multinacionális, randomizált, kettős vak vizsgálat volt 8442 beteg részvételével. A cél a sacubitril/valsartan és az enalapril összehasonlítása volt krónikus szívelégtelenségben (New York Heart Association II-IV. osztály) és csökkent bal kamrai ejekciós frakcióban (LVEF ≤ 40%, később ≤ 35%-ra módosítva) szenvedő felnőtt betegeknél, egyéb szívelégtelenség-terápia mellett.1 Az elsődleges végpont a kardiovaszkuláris halál vagy szívelégtelenség miatti kórházi kezelés összetett értéke volt. A vizsgálatban való részvételt megelőzően a betegeket a szokásos terápiával kezelték, amely ACEI/ARB-ket (> 99%), béta-blokkolókat (94%), mineralokortikoid-antagonistákat (58%) és diuretikumokat (82%) tartalmazott. A medián követési idő 27 hónap volt, és a betegeket legfeljebb 4,3 évig kezelték.
A betegeknek meg kellett szakítaniuk a meglévő ACEI- vagy ARB-terápiájukat, és be kellett lépniük egy szekvenciális, egyszeri vak, bevezető időszakba. A befutási időszak alatt napi kétszer 10 mg enalaprillal kezelték őket, majd ezt követte a napi kétszer 100 mg sacubitril/valsartan egy vak kezelés, amelyet napi kétszer 200 mg-ra emeltek. Ezt követően randomizálták őket a vizsgálat kettős vak periódusára. Ebben az időszakban vagy 200 mg sacubitrilt/valsartánt, vagy 10 mg enalaprilt kaptak, naponta kétszer. A vizsgált populáció átlagéletkora 64 év volt, és 19%-uk 75 éves vagy idősebb volt. A randomizáláskor a betegek 70%-a II. NYHA-osztályú, 24%-a III. osztályú, 0,7%-a pedig IV. osztályú volt. Az átlagos LVEF 29% volt, és 963 (11,4%) olyan beteg volt, akiknél a kiindulási LVEF > 35% és ≤ 40% volt. A vizsgálatot idő előtt befejezték, mivel a kardiovaszkuláris okokból bekövetkező halálozás és az összetett elsődleges végpont (kardiovaszkuláris halálozás vagy szívelégtelenség miatti kórházi kezelés) csökkenése túlnyomó mértékben csökkent. A PARADIGM-HF vizsgálatot 20%-os vizsgálatnak is nevezik, az összes vizsgált végpont, köztük a kardiovaszkuláris halál, a hirtelen szívhalál és a szívelégtelenség miatti kórházi kezelés összetett elsődleges végpontjának homogén ∼20%-os relatív csökkenése miatt (1. táblázat).
PARADIGM-HF vizsgálat: Treatment Effects on the Primary Composite Endpoint, Its Components, and All-cause Mortality, A medián követési idő alatt…up of 27 Months
| Endpontok | Veszélyességi arány (95%CI) | Relatív kockázatcsökkenés. | P |
|---|---|---|---|
| Elsődleges összetett végpont: CV halálozás és szívelégtelenség miatti kórházi felvételek | 0.80 (0,73-0,87) | 20% | .0000002 |
| Az elsődleges összetett végpont egyes komponensei | |||
| CV halálozás | 0,80 (0,71-0,87).89) | 20% | .00004 |
| Első szívelégtelenséggel járó kórházi kezelés | 0,79 (0,71-0,89) | 21% | .00004 |
| Második végpont | |||
| Összhalálozás | 0,84 (0,76-0,93) | 16% | .0005 |
95%CI, 95%-os konfidenciaintervallum; CV, cardiovascular-related.
Noha a sacubitril/valsartan hatalmas ígéretet mutatott, vannak kihívások és megoldatlan kérdések, amelyek további vizsgálatokat és további tisztázást érdemelnek (2. táblázat). E kérdések közül néhányat az Európai Gyógyszerügynökség Entresto-ra vonatkozó értékelő jelentésében felvetettek és megvitattak7 .
A Sacubitril/Valsartan biztonságossági aggályainak összefoglalása
| Fontos azonosított kockázatok | Hypotenzió Veseelégtelenség Hyperkalémia Angioödéma |
| Fontos potenciális kockázatok | Hepatotoxicitás Kognitív károsodás Statintartalmú gyógyszer-gyógyszer kölcsönhatás Thrombocitopénia Neutropénia |
| Hiányzó információk | Pediatriai betegek HF-ben Súlyos vesekárosodásban szenvedő betegek Hosszú…Hosszú távú adatok a sacubitril/valsartan alkalmazásáról HF-ben Hatások ACEI/ARB-naiv HF-ben szenvedő betegeknél |
ACEI, angiotenzin-konvertáló enzim gátló; ARB, angiotenzin II receptor blokkoló; HF, szívelégtelenség.
Módosítva az Európai Gyógyszerügynökség értékelő jelentéséből7.
Először is, ha a betegek tolerálhatósági problémákat tapasztalnak (pl. ≤ 95 mmHg szisztolés vérnyomás, tüneti hipotenzió, hiperkalémia, veseelégtelenség), a jelenlegi ajánlások szerint a kísérő gyógyszereket módosítani kell, és/vagy a sacubitril/valsartánt le kell adagolni vagy átmenetileg abba kell hagyni. Valójában az Európai Gyógyszerügynökség azt ajánlja, hogy a kezelést nem szabad megkezdeni olyan betegeknél, akiknek szérum káliumszintje > 5,4 mmol/L vagy szisztolés vérnyomása
mmHg.
Másrészt, korlátozottak az adatok azon betegek esetében, akik jelenleg alacsony dózisú ACEI-t vagy ARB-t szednek vagy nem szednek. Ezért ezeknek a betegeknek a jelenlegi ajánlások szerint naponta kétszer 50 mg-os adaggal kell kezdeni, és az adagot lassan kell titrálni (3-4 hetente megduplázva).
Harmadszor, a sacubitril/valsartan nem adható együtt ACEI-vel vagy ARB-vel. ACEI-vel való egyidejű alkalmazás esetén nagy az angioödéma potenciális kockázata. Következésképpen a sacubitril/valsartánt az ACEI-terápia megszakítása után legalább 36 órával nem szabad elkezdeni.
Negyedszer, enyhe vesekárosodásban szenvedő betegeknél (becsült glomeruláris filtrációs ráta 60-90ml/min/1,73 m2) nem szükséges az adag módosítása. Közepes mértékű veseelégtelenségben szenvedő betegeknél (becsült glomeruláris filtrációs ráta 30-60mL/min/1,73 m2) azonban napi kétszer 50 mg-os kezdő adagot kell megfontolni. Végstádiumú vesebetegségben szenvedő betegekről nincsenek adatok, de a sacubitril/valsartan alkalmazása ezeknél a betegeknél nem javasolt.
Ötödször, a NYHA IV funkcionális besorolású betegeknél a sacubitril/valsartan alkalmazásának megkezdésekor óvatosságra van szükség, az ebben a populációban szerzett korlátozott klinikai tapasztalat miatt.
Sixth, a BNP nem alkalmas szívelégtelenség biomarkere a sacubitril/valsartánnal kezelt betegeknél, mivel neprilizin-szubsztrát. Javasolt az NT-proBNP-re, mint natriuretikus peptid biomarkerre való áttérés.
Hetedszer, a neprilizin-gátlással kapcsolatos elméleti kockázat a neprilizin-szubsztrát, az amiloid-β felhalmozódásához kapcsolódik az agyban.8 A PARADIGM-HF vizsgálatban nem jelentették a kognícióval vagy demenciával kapcsolatos mellékhatások fokozott előfordulását. Lehetséges azonban, hogy ezeket a hatásokat eddig nem észlelték, mivel a demencia kialakulása hosszabb időt vehet igénybe, mint a vizsgálatban résztvevők jelenlegi megfigyelési időszaka. Emellett az enyhe demenciában szenvedő alanyok várhatóan nem vettek részt a vizsgálatban. A folyamatban lévő III. fázisú PARAGON-HF vizsgálatban azonban bevezették a kognitív funkciók értékelését.
A szakubitril/valsartán és az atorvasztatin együttes alkalmazása akár 2-szeresére növelte az atorvasztatin és metabolitjainak Cmax értékét. A PARADIGM-HF vizsgálatban a sacubitril/valsartánt és sztatint egyaránt kapó betegeknél nem volt jelentős növekedés a potenciális sztatinnal kapcsolatos mellékhatásokban. Mindazonáltal további elemzések azt mutatták, hogy a nagyobb sztatinadagok több nemkívánatos eseménnyel jártak együtt, ha sacubitril/valsartánnal vagy enalaprillal kombinálták őket. A mintázatok azonban eltérőek voltak, a beadott specifikus sztatintól függően. A további vizsgálatok eredményeire várva óvatosságot javasoltak ezzel a gyógyszerkombinációval kapcsolatban.7
A PARADIGM-HF vizsgálat a korlátozott LVEF-fel rendelkező krónikus szívelégtelenségre összpontosít. Így felmerül a kérdés: Mi a helyzet a szívelégtelenségben szenvedő, de megőrzött ejekciós frakciójú betegek másik 50%-ával, más néven HFpEF betegekkel? Jelenleg hiányoznak a HFpEF-re vonatkozó klinikai vizsgálatok, amelyek a csökkent ejekciós frakciójú betegeknél általánosan alkalmazott szerek terápiás előnyeit bizonyították volna. Következésképpen a HFpEF terápiái a tünetek kezelésére és a kardiovaszkuláris kockázati tényezőkre irányulnak. A HFpEF-ben szenvedő betegek körében azonban a sacubitril/valsartan ígéretes biztonsági és hatékonysági eredményeket mutatott egy 2. fázisú vizsgálatban. A PARAMOUNT vizsgálat egy randomizált, kettős vak, párhuzamos csoportos, aktív kontrollált vizsgálat volt, amely a sacubitril/valsartánt hasonlította össze a csak valsartánnal.9 Az elsődleges végpont az NT-proBNP kiindulási értékéhez képest 12 hét alatt bekövetkezett változás volt. A csoportok hasonló kiindulási jellemzőkkel rendelkeztek. A legtöbb beteg idős, nő, túlsúlyos és a NYHA II. osztályba sorolt volt. A 4. héten nagyobb NT-proBNP-csökkenést észleltek a sacubitril/valsartan csoportban, mint a valsartan csoportban, de ez nem érte el a szignifikanciát (P = .063). A 12 héten az NT-proBNP szignifikánsan csökkent a sacubitril/valsartán csoportban a valsartánhoz képest (P = .005). A PARAMOUNT eredményei azt sugallták, hogy a sacubitril/valsartánnak kedvező hatásai lehetnek a HFpEF-ben szenvedő betegeknél. A HFpEF-populáció további vizsgálata folyamatban van a PARAGON vizsgálatban, amely egy multicentrikus, randomizált, kettős vak, párhuzamos csoportos, aktív kontrollált vizsgálat. Ennek a vizsgálatnak a célja a szakubitril/valsartán hatékonyságának és biztonságosságának értékelése a valsartánnal összehasonlítva a morbiditásra és mortalitásra vonatkozóan szívelégtelenségben (NYHA II-IV. osztály) és megőrzött ejekciós frakcióban szenvedő betegeknél.
Végül, de nem utolsósorban, nagyon nemrég javasolták a keringő oldható neprilizin (sNEP) mint feltételezett biomarkert.2 Jelenleg az sNEP-re vonatkozó adatok azt sugallják, hogy prognosztikai szerepet játszhat mind krónikus10 , mind akut dekompenzált szívelégtelenségben,11 de a HFpEF-ben az eredmények ellentmondásosak.12 Érdekes módon a keringő sNEP katalitikusan aktívnak bizonyult.13 Sőt, egy közelmúltbeli jelentés azt mutatta, hogy az sNEP még az NT-proBNP-nél is jobb lehet, mint a szívelégtelenség neurohormonális tengelyének helyettesítő prognosztikai biomarkere.14 Az sNEP-mérések további finomítása kötelező a klinikai gyakorlatban való bevezetése előtt. Az eddig közölt adatok azonban arra utalnak, hogy értékes eszközzé válhat a betegek prognosztikájában és végül a terápiás irányításban.
Epilógusként az új szerrel történő kezelés költsége valószínűleg akadályt jelent majd a mindennapi valós klinikai gyakorlatban való alkalmazásának, mivel a hatékony szerek, például az ACEI enalapril költsége nagyon alacsony (sok országban a rágógumi árához hasonlítható). Elképzelhető, hogy egy biomarker-vezérelt stratégia bevezetését lehet javasolni, hogy a legbetegebb betegeknél előnyben részesítsék az ACEI-kezelésről az Entresto-ra való átállást. E szempontok mentén figyelemre méltó, hogy a PARADIGM-HF vizsgálatban a natriuretikus peptidek alkalmazása a befogadási kritériumok között szerepelt. A sacubitril/valsartan költséghatékonysága és az egy megnyert, minőséggel korrigált életévre jutó költsége az enalaprilhoz képest a HFrEF kezelésében intenzív kutatást érdemel az ország és az egészségügyi ellátórendszer szerint kiigazított valós forgatókönyvek alapján.15
INTERJÚKONFLIKTUSOK
A. Bayes-Genis és J. Lupón szabadalmat nyújtottak be az sNEP-re mint prognosztikai biomarkerre, amelynek engedélyezése folyamatban van. A. Bayes-Genis előadásokat tartott és részt vett a Novartis tanácsadó testületeinek munkájában.