US Pharm. 2017;42(4):HS16-HS20.
ABSZTRAKT: A nekrotizáló lágyrészfertőzések (NSTI) a súlyos bakteriális fertőzések egyik típusa, amely az orvosok és sebészek gyors felismerését és beavatkozását igényli, időben megkezdett antibiotikumos kezeléssel együtt. E fertőzések oka lehet polimikrobiális, de a legtöbb esetben a meticillin-rezisztens Staphylococcus aureus az érintett. Az NSTI kezelésében az idő a legfontosabb az olyan szövődmények, mint az amputáció elkerülése érdekében, és a közelmúltban új gyógyszerek kerültek fel a kezelési lehetőségek listájára. Ezek az új antibiotikumok közé tartozik a tedizolid (Sivextro), az oritavancin (Orbactiv) és a dalbavancin (Dalvance). Figyelemre méltó, hogy mind a dalbavancin, mind az oritavancin hosszú felezési ideje lehetővé teszi az egyszeri adagolású kezelést vagy a heti egyszeri adagolást.
A nekrotizáló lágyrészfertőzés (NSTI) tágabb kifejezés, mint a nekrotizáló fasciitis, mivel az NSTI-ben a fertőzés túlterjedhet a fascián. A köznyelvi kifejezések közé tartozik a “húsevő baktérium” és a “húsevő fertőzés”. Ezt a fertőzéstípust először Hippokratész jegyezte fel az i. e. 5. században, aki a következőképpen írta le: “Sokakat megtámadott az erysipelas az egész testen, amikor az izgató ok egy jelentéktelen baleset volt… hús, inak és csontok hullottak le nagy mennyiségben… sok haláleset volt.”1 Azóta más leíró kifejezéseket is használtak az NSTI jellemzésére, mint például “phagedaenikus fekély, phagedena gangrenosus, gangrénás fekély, rosszindulatú fekély, rothadó fekély vagy kórházi gangréna. “2 Az gangréna kifejezést még mindig használják, mint például a Fournier-gangréna, amely a gát és a herezacskó nekrózisát jelenti.3
Epidemiológia
A NSTI kockázata összességében továbbra is alacsony, évente körülbelül 1000 eset fordul elő az Egyesült Államokban. Ez a szám azonban emelkedhet, talán a betegségállapot nagyobb tudatossága és felismerése, a növekvő antibiotikum-rezisztencia vagy a fokozott bakteriális virulencia-képesség miatt.4
Etiológia
A NSTI-ket anatómiai elhelyezkedés szerint osztályozzák (pl. Fournier gangréna), de leggyakrabban a végtagokon, a gáton és a nemi szerveken fordulnak elő. A gyakori bakteriális kórokozók közé tartoznak a meticillin-rezisztens Staphylococcus aureus (MRSA), a gram-negatív szervezetek és anaerobok, valamint az A csoportú streptococcusok (GAS).4
Klinikai megjelenés és diagnózis
A NSTI-ben szenvedő betegek kezdeti megjelenése utánozhatja a cellulitishez kapcsolódó tüneteket, beleértve az erythema, duzzanat, láz, induratio és a bőrelváltozások területén kívüli ödéma tüneteit.4 A betegek az izomhúzódáshoz hasonló fájdalmat vagy fájdalmat írhatnak le.5 A klinikusnak az NSTI gyanúját fokozó tünetek közé tartozik a vizsgálat során talált leletekkel aránytalan fájdalom (a betegség korai szakaszában), a bullák jelenléte, a bőr elhalását megelőző ekchymózis, a szövetekben lévő gázok és a bőr érzéstelensége. Ezenkívül a cellulitis diagnózisú betegekhez képest az NSTI-ben szenvedő betegeknél a fertőzés kronológiája a betegség sokkal gyorsabb lefolyására utal.4 Ezért a cellulitisre gyanús betegeknél ki kell zárni a nekrotizáló fasciitis diagnózisát.6 A fertőzés kialakulásához a baktériumoknak a véráramba kell jutniuk, általában egy olyan seb (a hám- vagy nyálkahártya felszínén keletkezett sérülés) révén, mint egy kisebb vágás vagy karmolás, rovarcsípés, bőrfekély vagy műtét utáni seb; esetenként azonban az ilyen sérülések nem azonosíthatók. Az NSTI kockázati tényezői közé tartozik az immunhiányos állapot (AIDS, szteroidterápia), az elhízás, az alkoholfogyasztás, a rák, a cukorbetegség, a perifériás érbetegség, a vesebetegség, az alultápláltság és más krónikus állapotok. Az aktív parenterális kábítószer-használat (tiltott anyagok intravénás vagy szubkután injekciózása) szintén kockázati tényezőnek bizonyult, különösen városi környezetben.7
Útmutató áttekintés
A 2014-es Infectious Diseases Society of America (IDSA) gyakorlati útmutatója a bőr- és lágyrészfertőzések diagnózisához és kezeléséhez tartalmaz információkat a bőr- és lágyrészfertőzések valamennyi típusának kezeléséről, az egyszerű cellulitistől a bőr lépfene fertőzéséig, egészséges egyéneknél és veszélyeztetett betegeknél. Mivel ezek a fertőzések minden korcsoportban előfordulnak, az irányelvek a gyermek- és felnőtt betegek számára egyaránt tartalmaznak ajánlásokat. Az irányelvek egy alfejezete az NSTI-vel kapcsolatos információkat tartalmaz. A kezelésre vonatkozó konkrét ajánlásokat a klinikai irányelvekben szereplő ajánlások értékelésére szolgáló IDSA/U.S. Public Health Service osztályozási rendszernek megfelelően az ajánlásra vonatkozó bizonyítékok erősségét jelző minősítés alapján adják meg.6 Az irányelv 24 klinikai kérdésre ad választ, köztük két, az NSTI-vel kapcsolatos kérdésre.
Az első, az NSTI-vel kapcsolatos kérdés, amellyel az irányelv foglalkozik, a következő: Mi az előnyben részesített értékelés és kezelés a nekrotizáló fasciitis, beleértve a Fournier-gangrénát is? Az első ajánlás a szisztémás toxicitás jeleit mutató agresszív fertőzésben szenvedő betegeknél, vagy ha nekrotizáló fasciitis vagy gázgangréna kialakulásának veszélye áll fenn, azonnali sebészeti konzultációt javasol.6 Ezt két ajánlás követi az antibiotikum-terápiával kapcsolatban. A kezdeti antimikrobiális terápiának széles körűnek kell lennie, hogy az egy- és többszervezetes fertőzéseket egyaránt lefedje. Ezen túlmenően a dokumentált GAS nekrotizáló fasciitis esetén a penicillin és a klindamicin kombinációja ajánlott. Mindhárom ajánlás értékelése erős, alacsony minőségű bizonyítékokkal, ami azt jelzi, hogy a kívánatos hatások egyértelműen meghaladják a nemkívánatos hatásokat. Az ajánlások után a bizonyítékok áttekintése következik, majd a leggyakoribb klinikai jellemzők, a mikrobiológiai okok (monomikrobiális versus polimikrobiális), a diagnózis és a kezelés áttekintése.
Az irányelvek külön szakasza a clostridialis NSTI kezelésével foglalkozik a következő kérdés szerint: Mi a megfelelő megközelítés a klostridiumos gázgangréna vagy myonecrosis értékelésére és kezelésére? Először is, sürgősen el kell végezni a feltételezett gázgangréna helyének sebészeti feltárását és az érintett szövetek eltávolítását. Széles spektrumú antibiotikum-terápia javasolt, hacsak nincs egyértelmű mikrobiológiai ok. Clostridiumos myonecrosis esetén penicillin és clindamycin kombinációja javasolt. Végül a hiperbár oxigénterápia nem javasolt. E javaslatok mindegyike erős ajánlással rendelkezik, és a sebészeti ajánlás kivételével mindegyik alacsony minőségű bizonyítékkal rendelkezik (a sebészeti ajánlás közepes minőségű bizonyítékkal rendelkezik). Az ezen ajánlásokat övező bizonyítékok áttekintése zárja az NSTI-ről szóló szakaszt.6
Amellett, hogy az NSTI-k klinikai megjelenésükben és egyéb szisztémás manifesztációikban különböznek a kevésbé súlyos bőrfertőzésektől, más megközelítést igényelnek a kezelésben is. Az NSTI-nek számos fajtája létezik, de az antibiotikum-kezelés és a sebészeti megközelítés minden típus esetében hasonló, és a sebészeti beavatkozás az elsődleges megközelítés, ha NSTI várható. A legtöbb betegnél többször kell a műtőbe (OP) menni, amíg a debridement már nem szükséges.6
gyógyszeres kezelés
A kezdeti antibiotikum-választásnak olyan szereket kell magában foglalnia, amelyek az organizmusok széles körével szemben aktívak, beleértve az aerobokat, MRSA-t és anaerobokat (1. TÁBLÁZAT).6 Az antibiotikumok kiválasztásakor figyelembe kell venni a betegre jellemző tényezőket, például a korábbi antibiotikum-expozíciót, az egyidejűleg fennálló betegségeket, szervi diszfunkciókat és allergiákat. Mint a legtöbb fertőzés kezelésében, a jó antimikrobiális stewardship magában foglalja az antibiotikum-terápia optimalizálását a legszűkebb spektrumra, amint a mikrobiológiai okot azonosították.
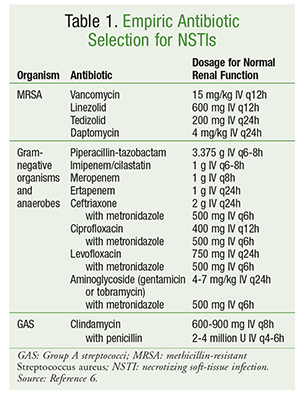
Az NSTI definiált kezelése többféle antibiotikumot tartalmaz. Polimikrobiális fertőzések esetén gyakran széles spektrumú antibiotikum-terápiát folytatnak. GAS által okozott fertőzések esetén mind a klindamicint, mind a penicillint alkalmazni kell. A klindamicin hozzáadása elnyomja a toxin- és citokintermelést, a penicillin alkalmazása pedig fedezetet nyújt a GAS klindamicinrezisztenciája esetén. A meticillinre érzékeny S aureus által okozott fertőzések esetén a nafcillin, oxacillin vagy cefazolin használata előnyös. A klostridiumos fertőzéseket penicillinnel kombinált klindamicinnel kell kezelni. Az antibiotikum-terápiát általában addig kell folytatni, amíg nincs szükség további debridementre, a beteg klinikai javulást mutat, és a láz 48-72 órán keresztül nem jelentkezik.6
A 2014-es IDSA-irányelvek közzététele óta számos új antibiotikumot engedélyeztek a bonyolult bőr- és lágyrészfertőzések kezelésére. Ezek a szerek a tedizolid (Sivextro), az oritavancin (Orbactiv) és a dalbavancin (Dalvance).
A tedizolid a linezolidhoz hasonló oxazolidinon antibiotikum. Megbízható aktivitással rendelkezik az MRSA és más multidrog-rezisztens gram-pozitív organizmusok ellen. A linezolid napi kétszeri adagolásával ellentétben a tedizolidot napi egyszeri adagban, szájon át vagy intravénásan adják. A tedizolid kedvezőbb mellékhatás- és gyógyszerkölcsönhatás-profillal rendelkezhet a linezolidhoz képest.8 Bár a tedizolidot tanulmányozták akut bakteriális bőr- és bőrszerkezeti fertőzések kezelésében, nem vizsgálták NSTI-ben.
A dalbavancin és az oritavancin akut bakteriális bőr- és bőrszerkezeti fertőzések kezelésére engedélyezett lipoglikopeptidek. Ezek a szerek egyedülállóak abban, hogy hosszú felezési idejük van, ami lehetővé teszi az egyszeri adagolású vagy a heti egyszeri adagolású kezelést. A dalbavancin adagját csökkenteni kell a <30 ml/perc kreatinin-clearance-értékkel rendelkező betegeknél. Az oritabavancin nem igényel szervi diszfunkcióval összefüggő dózismódosítást, de nem alkalmazható heparint kapó betegeknél, mivel mesterségesen meghosszabbítja a véralvadási teszteket. Az oritavancin fokozhatja a K-vitamin-antagonisták, például a warfarin hatását is.9 Mindkét szer bizonyítottan hatásos a bőr- és bőrszerkezeti fertőzések kezelésében, de nem értékelték alkalmazásukat nekrotizáló fertőzésekben.
A NSTI kiegészítő terápiái közé tartozik az intravénás immunglobulin (IVIG) és a hiperbár oxigénterápia. Az IVIG-t a streptococcusfertőzésekben termelődő toxinok lehetséges semlegesítése miatt tartják előnyösnek. Ezeknek a toxinoknak a csökkentése potenciálisan csökkentheti az NSTI-ben gyakran megfigyelhető szervi elégtelenség, sokk és szövetpusztulás egy részét.6 Az IDSA-irányelvek kiadásakor (2014 áprilisában) egy megfigyelési tanulmány és egy európai vizsgálat már beszámolt az IVIG sztreptococcusfertőzésekben való alkalmazásának bizonyos sikereiről.6 A hatékonyságot alátámasztó bizonyítékok hiánya miatt azonban az IVIG alkalmazása jelenleg nem ajánlott.
Egy újabb vizsgálat a klindamicin és az IVIG hatékonyságát írta le invazív GAS-fertőzésekkel szemben.10 Nyolcvannégy beteg felelt meg az invazív GAS-betegség kritériumainak, és 14 betegnél alkalmaztak IVIG-t, köztük nyolcnál nekrotizáló fasciitist. A halálozás alacsonyabb volt a klindamicinnel és IVIG-vel kezelt betegeknél, de ez a különbség nem volt szignifikáns. Bár nem volt statisztikai különbség a halálozásban, amikor a klindamicinhez IVIG-t adtak, a szerzők szerint a súlyosabb betegségben szenvedő felnőtteknél lehetséges előnye lehet.10
A hiperbár oxigénterápiát (HBOT) szorgalmazzák a gázgangréna kezelésében, de szerepe ellentmondásos.6 Laboratóriumi vizsgálatok kimutatták, hogy az oxigénben gazdag szöveti állapotok segítenek elnyomni a Clostridium perfringens szaporodását és fokozzák a gazdaszervezet idegen sejtekkel szembeni védekezőképességét, de hiányoznak a kritériumok annak meghatározására, hogy kik azok a betegek, akiknek ez előnyös lehet, és hogy mikor kell a terápiát elkezdeni.6,11 Semmi sem késleltetheti a sürgős sebészeti debridementet és az antibiotikum beadását, mivel mindkettő fontos a túlélés biztosításában.6
Miatt a publikált tanulmányok többsége kicsi és nem elég erős, egy tanulmányt végeztek a HBOT alkalmazásával kapcsolatos adatok értékelésére több HBOT-berendezéssel rendelkező központból.11 Egy 3 éves időszak alatt 14 HBOT-berendezés 1583 NSTI-esetet látott, és 117 esetben nyújtott adjuváns HBOT-ot. A HBOT-csoportban megnövekedtek a költségek és hosszabb volt a kórházi tartózkodás hossza, mint a kontrollcsoportban, de szignifikánsan alacsonyabb volt a kórházi halálozási arány (5% vs. 12%; P <,05). A betegség súlyosságát figyelembe véve a legsúlyosabb beteg HBOT-betegeknél szignifikánsan alacsonyabb volt a halálozás és a szövődmények aránya, de a kórházi tartózkodás hosszában és a költségekben nem volt különbség. A többváltozós elemzés kimutatta, hogy azok a betegek, akik nem részesültek HBOT-ban, nagyobb valószínűséggel haltak meg a kórházi kezelés alatt (esélyhányados, 10,6; 95% CI 5,2-25,1). A betegség súlyosságának minden egyes növekedése a halálozás megnövekedett kockázatával járt.
Ez a 14 HBOT-létesítményt vizsgáló tanulmány úgy tűnik, hogy jobb eredményeket mutat, különösen a legbetegebb betegek esetében, akiket közvetlenül egy olyan központba vettek fel, amely képes biztosítani ezt a kezelést.11 Ez azonban nem enyhíti a HBOT alkalmazása körüli vitákat, mivel ennek a vizsgálatnak számos korlátja volt. A vizsgálatot retrospektív módon végezték, egy akadémiai egészségügyi központok adminisztratív adatbázisának felhasználásával. Emellett egyes központoknál előfordulhat, hogy a HBOT-berendezés tulajdonosa egy harmadik fél, így az eredmények kevésbé általánosíthatók az ilyen intézmények betegeire. Egy randomizált, kontrollált vizsgálat hasznos lenne e terápia végső előnyeinek meghatározásában.
Szövődmények
A NSTI-vel kapcsolatos halálozási arány a hipotenzióval és szervi elégtelenséggel kombinált GAS nekrotizáló fasciitisben szenvedő betegeknél 30-70%-ra tehető.6 Mivel a kezelés többszörös műtéti látogatással jár, rendszeresen nagy sebekről és esetleges amputációkról számolnak be. Az NSTI gyakori szövődményei közé tartoznak az egyéb szövődmények, mint például a helyreállító műtétek, a szepszis, a nosokomiális fertőzések és a többszervi elégtelenség kialakulása miatt elhúzódó intenzív ellátási idő.12
A NSTI hosszú távú hatásairól 18 túlélővel készített mélyinterjúkból gyűjtöttek információkat.12,13 A vizsgálók megállapították, hogy a bejelentett életminőséget jelentősen befolyásolja a fizikai funkció és a folyamatos fájdalom. A tapasztalatok családi és egyéb kapcsolatokra gyakorolt hatását is jelentősnek találták. Több túlélő leírta a betegség hosszú távú pszichológiai következményeit, beleértve a depressziót és a poszttraumás stresszt.
Következtetés
A kórházi gyógyszerészek nagyon alkalmasak arra, hogy segítsenek az NSTI-s betegek ellátásában, beleértve az ellátás racionalizálását; az antimikrobiális stewardship előmozdítását; valamint a klinikai eredmények javítását, a költségek csökkentését, a szövődmények minimalizálását és a visszafogadást. A gyógyszerész további feladatai közé tartozik az új, de drágább terápiás szerek (pl. oritavancin) számára ideális betegek azonosítása és az ezekkel az antibiotikum osztályokkal való gyógyszerkölcsönhatások (pl. véralvadásgátlók) felismerése.
1. Descamps V, Aitken J, Lee MG. Hippokratész a nekrotizáló fasciitisről. Lancet. 1994;344:556.
2. Loudon I. Necrotising fasciitis, hospital gangrene, and phagedena. Lancet. 1994;344:1416-1419.
3. Sarani B, Strong M, Pascual J, Schwab CW. Nekrotizáló fasciitis: jelenlegi koncepciók és az irodalom áttekintése. J Am Coll Surg. 2009;208:279-288.
4. Hakkarainen TW, Kopari NM, Pham TN, Evans HL. Nekrotizáló lágyrészfertőzések: áttekintés és aktuális koncepciók a kezeléssel, ellátórendszerekkel és eredményekkel kapcsolatban. Curr Probl Surg. 2014;51:344-362.
5. CDC. Nekrotizáló fasciitis: ritka betegség, különösen az egészségesek számára. www.cdc.gov/features/necrotizingfasciitis/. Hozzáférés 2016. november 29.
6. Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: Az Amerikai Fertőző Betegségek Társaságának 2014-es frissítése. Clin Infect Dis. 2014;59:147-159.
7. Bosshardt TL, Henderson VJ, Organ CH Jr. nekrotizáló lágyrészfertőzések. Arch Surg. 1996;131:846-852.
8. Kisgen JJ, Mansour H, Unger NR, Childs LM. Tedizolid: egy új oxazolidinon antimikrobás szer. Am J Health Syst Pharm. 2014;71:621-633.
9. Roberts KD, Sulaiman RM, Rybak MJ. Dalbavancin és oritavancin: innovatív megközelítés a gram-pozitív fertőzések kezelésében. Farmakoterápia. 2015;35:935-948.
10. Carapetis JR, Jacoby P, Carville K, et al. A klindamicin és az intravénás immunglobulin hatékonysága, valamint a kontaktok megbetegedésének kockázata invazív A csoportú streptococcus fertőzésekben. Clin Infect Dis. 2014;59:358-365.
11. Shaw JJ, Psoinos C, Ernhoff TA, et al. Not just full of hot air: Hyperbaric oxygen therapy increases survival in cases of necrotizing soft tissue infections. Surg Infect (Larchmt). 2014;15:328-335.
12. Hakkarainen TW, Burkette Ikebata N, Bulger E, Evans HL. Túllépve a túlélésen mint a siker mércéjén: a nekrotizáló lágyrészfertőzések betegélményeinek megértése. J Surg Res. 2014;192:143-149.
13. Miller LG, Perdreau-Remington F, Rieg G, et al. A közösségben előforduló meticillinrezisztens Staphylococcus aureus által okozott nekrotizáló fasciitis Los Angelesben. New Engl J Med. 2005;352:1445-1453.