Introduction
Az epevezetékek hámjából kiinduló daganat, a kolangiokarcinóma (CC) a hepatobiliáris daganatok 10%-át, a rosszindulatú daganatok 2%-át teszi ki.1,2 A CC az epevezetéken belüli anatómiai eredettől függően 3 altípusra osztható: intrahepatikus vagy perifériás CC (ICC), perihilaris CC vagy Klatskin-tumor (PHC) és disztális CC.
A jelen felülvizsgálat tárgyát képező PHC a leggyakoribb, és az összes CC mintegy 40%-60%-át teszi ki.2,3 Ez a daganat agresszív és csendes, előrehaladott stádiumig nem specifikus tünetekkel, ami késői diagnózishoz és rövid, 6-12 hónapos műtét nélküli túléléshez vezet.4 A műtét, amely az egyetlen rendelkezésre álló gyógyítási lehetőség, a diagnózis felállításakor csak a betegek körülbelül 47%-ánál lehetséges.5-8 A legfontosabb prognosztikai tényezők e daganat esetében általában a műtéti lehetőségekhez kapcsolódnak, és a tumor stádiuma, mérete, ganglionok és érrendszeri érintettség, intrahepatikus áttétek és szövettani típus a legfontosabb tényezők.9-11
Anatómiai tér
A PHC által elfoglalt anatómiai teret a disztális szinten a cisztás ductus bejárata, a proximális szinten pedig a jobb és bal májvezeték bifurkációja határolná.1,12 A legszélesebb körben használt osztályozások szerint az összes CC az epeúti összefolyásból vagy annak környezetéből ered. Egyes csoportok szerint a májparenchimából kiinduló CC néha behatolhat az epeúti összefolyásba, és eredete a hátsó jobb kapuvéna ágának forrása és a falciform ligamentum által határolt anatómiai térben van.13-15 Ezeket az epeúti összefolyást érintő ICC-ket ugyanúgy kezelnék, mint az extrahepatikus eredetű tumorokat, és túlélésük hasonló az azonos stádiumú PHC-hez. Ezek általában magasan fejlett tumorok, lokoregionális ér- és nyirokcsomóinvázióval. Az e daganatok biológiai viselkedésével kapcsolatos kételyek számos csoportot arra késztettek, hogy kizárják őket a perihilaris tumorok közül. Az Ebata és munkatársai által közzétett tanulmányban13,15 250, a konfluens érintettségű CC miatt reszekált beteg esetében a stádiumot és a túlélést aszerint elemezték, hogy a tumor intrahepatikus volt-e a konfluens érintettségével (ICC), vagy a tumor eredete az extrahepatikus epevezetékben volt (PHC). Összesen 83 betegnél volt ICC és 167 PHC. A stádiumok összehasonlításakor az ICC-s betegeknél gyakoribb volt az ér- és nyirokcsomó érintettség, a TNM magasabb volt, mint a PHC csoportnál, az esetek 59%-ában iii. és iv. stádiumban, míg a PHC csoportban 38%-ban. Mindazonáltal, ha a túlélést a két csoportban a stádiumok szerint osztjuk fel, 5 év alatt nincs statisztikailag szignifikáns különbség, a PHC csoportban a teljes túlélés valamivel magasabb (20% vs. 29%; P=,057), így arra a következtetésre jutottunk, hogy a kezelés és a túlélés szempontjából összehasonlíthatóak. A diagnosztikai tesztek és a szövettani ismeretek javulásával a jövőben talán jobban meg tudjuk határozni, hogy 2 különböző entitásról van-e szó, vagy klinikailag és biológiailag azonosak.
Hisztopatológiai jellemzők
A PHC 90%-a adenokarcinóma. A 10% adenoszkámos vagy laphámos karcinóma, amelyhez néhány esetben a kórtörténetben előfordult litiazis, ciszták vagy az epeutak anomáliái társultak. A daganat megjelenése, a növekedés típusa, valamint a PHC biológiai és klinikai viselkedése alapján a következő osztályokba sorolják16,17:
- –
Tumoros vagy “tömegképző” CC: ez a leggyakoribb megjelenési forma az ICC-ben, bár nagyszámú PHC-ben is megtalálható. Jellemzője a tumoros tömeg kialakulása, jól körülhatárolt peremekkel. Jelentős fibrotikus reakcióval jár, és gyakori a centrális nekrózis is. Ez a daganat az epevezeték nyílásából ered, behatol az epevezeték falába és háromdimenziós növekedéssel terjed, csomószerű tömeget képezve, amely obstruktív tüneteket okoz.16-19
- –
Infiltráló periductalis CC: az ilyen típusú tumorok az epevezeték mentén koncentrikus hosszanti megvastagodás formájában nőnek a vezetéket körülvevő kötőszöveten keresztül, az érintett epevezeték szűkületét vagy teljes elzáródását okozva.19 A PHC-k többsége ilyen típusú, és képalkotó eljárásokkal nehezen azonosíthatók.17
- –
Intraductalis vagy intraductalis papilláris CC: erre a fajtára jellemző, hogy az epevezetékben felületes és intraluminális tumorok vannak jelen. Ezek mucint termelnek, és a csatornák részleges elzáródását és tágulását okozzák.16 Ez a daganat alacsony fokú rosszindulatú és általában kis méretű, bár az epeúti nyálkahártyán keresztül terjedhet, és többszörös daganatokat hozhat létre (papilomatosis vagy papilláris karcinomatosis).20
A differenciálás jelentősége a túlélés eltéréseiben rejlik az adott altípustól függően. Számos tanulmány kimutatta, hogy az intraduktális papilláris típusban szenvedő betegek prognózisa jobb, mint a szklerális-noduláris változatban szenvedőké,21 az átlagos túlélés 55, illetve 33 hónap,22 míg az intraduktális papilláris altípusban ritkább az ér- és ganglionérintettség.
Összefoglalva, a PHC többsége a periductalis növekedésű adenokarcinóma, ami rosszabb prognózissal jár, míg az intraductalis növekedésű változat a legkevésbé gyakori, bár jobb prognózissal rendelkezik.
Stádiumbeosztási rendszerek
A PHC stádiumbeosztási rendszerei megkülönböztethetők műtét előtti és utáni osztályozásra. Az előbbiek közül, amelyeket a műtét tervezésekor használnak, a legfontosabb rendszer a Bismuth-Corlette osztályozás. Ez jelzi, hogy melyik lebeny van előnyben részesítve, és ezért megmutatja, hogy milyen típusú hepatektómiát kell alkalmazni (1. ábra).23 Ezt az osztályozást az 1970-es években találták ki, és nem veszi figyelembe sem a nyirokcsomók érintettségét, sem az áttétképzést, így ma már kevesebb prognosztikai értéke van.
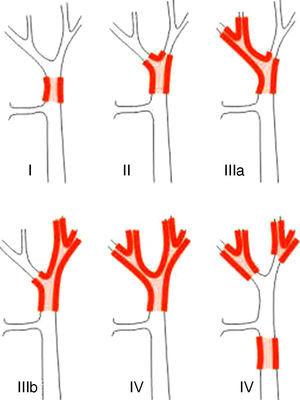
A Bismuth-Corlette23 osztályozás.
Az USA-ban használt másik preoperatív osztályozás a New York-i Memorial Sloan Kettering Cancer Centre Jarnagin et al.10 által közzétett osztályozás. Ennek az osztályozásnak a célja a tumorok reszekálhatóságának előrejelzése, 3 helyi kiterjedési tényező figyelembevételével. Ezek az epeúti kiterjedés, az érrendszeri érintettség és a lebeny atrófiája. Ez az osztályozás nem veszi figyelembe sem a nyirokcsomó érintettséget, sem az áttétképzést, így kisebb prognosztikai értékkel bír. Mivel a reszekálhatóság csoportonként eltérő, miközben a tendencia az egyre agresszívebb kezelések felé mutat, értéke az egyes központok nem reszekálhatósági kritériumaitól függ. A helyi érintettség ma már nem lehet a nem-rezekálhatóság kritériuma, azzal a feltétellel, hogy sebészi reszekcióval R0-t tudunk elérni.
A posztoperatív osztályozások közül a legszélesebb körben használt az Union for International Cancer Control (UICC) hetedik kiadású TNM-osztályozása.12 Ez az osztályozás figyelembe veszi a patológiai adatokat, például a helyi kiterjedést, az érrendszeri érintettséget, a nyirokcsomó-érintettséget és az áttétet, hogy olyan osztályozást hozzon létre, amely magában foglalja a daganat kiterjedését és prognosztikai jellegű.
A közelmúltban a “Japanese Study Group on Perihilar Cholangiocarcinoma” (JSGPH) közzétett egy tanulmányt, amely az “Union for International Cancer Control” osztályozásának módosítását javasolta. Az alapvető eltéréseket az 1. táblázat mutatja be, és ezek főként a következőkből állnak13:
-
A Bismuth IV-et nem tekintik T4-nek. A JSGPH osztályozása ezért nem veszi figyelembe a kétoldali epeúti kiterjedést, mint rossz prognózist, ha R0 reszekciót érnek el.
-
A stádiumok tekintetében a nyirokcsomó érintettséget helyezi előtérbe, mint a legrosszabb prognózist. Ezért a nyirokcsomó érintettséget iva és nem iiib stádiumnak tekintik (TNM7).
Az UICC TNM 7 osztályozás és a JSGPH javaslata közötti alapvető különbségek összehasonlítása.
| Tumorosztályozás | UICC | JSGPH javaslat | |
|---|---|---|---|
| Tis. | Carcinoma in situ | ||
| T1 | Az epeutakra korlátozódó daganat | ||
| T2a | Áthalad a ductus falán és behatol a perihilaris zsírszövetbe | ||
| T2b | Behatol a májparenchimába | ||
| T3 | Egyoldalú invázió a hepatikus artéria/véna | ||
| T4 | Invázió a HA/PV főágába, Bismuth IV, vagy Bismuth III, az A/V kontralaterális inváziójával | Vaszkuláris invázió a HA/PV fő márkáján, kétoldali érrendszeri vagy kontralaterális invázióval | |
| TNM stádium | |||
| 0 | Tis N0 M0 | ||
| I | T1 N0 M0 | ||
| II | T2 N0 M0 | ||
| IIIa | T3 N0 M0 | ||
| IIIb | T1-3 N1 M0 | T4 N0 M0 | |
| Iva | T4 N× M0 | T× N1 M0 | T× N1 M0 |
| Ivb | T× N× M1 | ||
HA, hepatikus artéria; JSGPH, Japanese Study Group on Perihilar Cholangiocarcinoma; TNM, tumor nyirokcsomó áttét; UICC, Union for International Cancer Control; PV, portális véna.
Európai szinten a “Nemzetközi Cholangiocarcinoma Group for the Staging of PHC” vezetésével létrehozták a sebészileg kezelt perihilar tumorok nemzetközi regiszterét. Ez a csoport új osztályozást1 tett közzé, amely figyelembe veszi a daganat méretét, valamint az epeúti, vénás, artériás, ganglionális és metasztatikus érintettséget, mind preoperatívan, mind posztoperatívan. Ennek az osztályozásnak azonban az a korlátja, hogy csupán a tumor jellemzőit és az elvégzendő műtétet írja le, anélkül, hogy e változók alapján csoportokra vagy stádiumokra osztaná a betegeket. Ennek következtében nem lehet prognosztikai következtetéseket levonni, és a különböző csoportok eredményeit sem lehet összehasonlítani.
A korábbi publikációk azt mutatják, hogy a rezekció típusának eldöntésére jelenleg a Bismuth-Corlette preoperatív osztályozást használják a legszélesebb körben, míg a hosszú távú prognózis meghatározására a TNM 7 osztályozást használják.
Diagnosztikai stratégiák
A PHC-hez gyakrabban társuló tünetek: sárgaság (90%), fogyás és hasi fájdalom (35%), viszketés (26%) és akut epehólyaghurut (10%).17 E tünetek miatt a kezdeti diagnózis felállítása általában hasi ultrahang segítségével történik, és ez jó szűrővizsgálat. Az ilyen típusú daganatok egyéb diagnosztikai vizsgálatai a következők lennének:
- –
Hasi Doppler-ultrahang: ez lehetővé teszi az artériás és portális áteresztőképesség (trombózis) értékelését, ami a daganat reszekálhatóságát és a terápiás stratégiát is befolyásolhatja, bár az érrendszeri érintettség értékelésére nem ez a vizsgálat a választás.
- –
Abdominális számítógépes axiális tomográfia: ez hasznos a primer tumor és a betegség kiterjedésének diagnosztizálásában, 80%-os érzékenységgel az epeúti kiterjedés értékelésében. Ez a választott technika az érrendszeri anatómia preoperatív értékelésére, 93%-os, illetve 87%-os érzékenységgel az artériás és a portális érintettség értékelésére. Alacsony az érzékenysége a nyirokcsomó érintettség preoperatív értékelésére (50%).14,24 Hasznos továbbá a volumetrikus vizsgálatok elvégzésében és a műtéti reszekció után megmaradó májtérfogat kiszámításában. Emellett ez a leggazdaságosabb vizsgálat a preoperatív stádiumbeállításhoz.
- –
Mágneses rezonancia és mágneses rezonancia kolangiográfia (RM-kolangiográfia): a legjobb vizsgálat a primer tumor diagnózisára és az epeúti kiterjedés értékelésére. Érzékenysége 86%-100%, és jobb, mint a direkt kolangiográfia, ugyanakkor nem invazív vizsgálat.25 Másrészt alacsony az érzékenysége az érrendszeri érintettség értékelésére (73%) és 80%-os a májparenchima inváziójára.
- –
Direkt kolangiográfia: endoszkópos retrográd kolangiopankreatográfia (ERCP) és transzparens hepatikus kolangiográfia (TPHC): ezek tájékoztatnak az epeúti elzáródás mértékéről, és lehetővé teszik az elváltozásból történő mintavételt citológiai vizsgálat céljából, 20%-os érzékenységgel. Ezeket a diagnosztikában mára felváltotta az MR-cholangiográfia. Nagyon hasznosak a preoperatív epedrenázsban és a PHC palliatív kezelésében, a lehetőleg fémbevonatú sztentek behelyezésével26.-28
- –
Endoszkópos ultrahang: ez hasznos a cöliákiás törzs és a peripankreatikus régió területén lévő ganglionok érintettségének értékelésére, a preoperatív stádium megállapítására, és lehetővé teszi a finom tűs aspirációs biopszia vételét.
- –
Pozitronemissziós tomográfia: ez hasznos az áttétes érintettség gyanúja esetén, valamint a cöliákiás törzs adenopátiás érintettségének vizsgálatában. Érzékenysége ellentmondásos, és a publikált sorozatoktól függően 38% és 90% között változhat.14,24,29
- –
Tumormarkerek: ezek korlátozottan hasznosak, a CA 19,9 a leggyakrabban használt. A tanulmányok többsége ezeket hasnyálmirigy-neoplasiákban és kisebb mértékben CC-ben értékelte, anélkül, hogy lokalizációjukat vagy jellemzőiket pontosították volna. E markerek szérumszintjét az epeúti obstrukció és a sárgaság epeúti eliminációjuk miatt erősen befolyásolja. A hepatopátia (300U/ml) vagy sárgaság (1000U/ml) jelenlététől függően különböző normálértékeket javasoltak, míg hasnyálmirigyrákban 70%-ot meghaladó érzékenységet, 95%-ot meghaladó specificitást értek el. Koncentrációja ezekben a betegekben széles skálán mozog, és nem korrelál a tumor méretével, bár korrelál az áttétes érintettséggel. Ennek a markernek az érzékenysége és specificitása növelhető a CEA-val való kombinálásával, mindenekelőtt a Lewis A negatív (CA 19,9-et nem termelő) esetekben.30
A fenti adatokból levezethető, hogy a PHC diagnózisának felállításához általában ultrahangvizsgálattal kezdjük a vizsgálatot. Erre sárgaságban szenvedő betegnél kerül sor, míg a komputertomográfia és az MR-cholangiográfia a legjobb stádiumvizsgálat és a műtétet megelőzően a leginkább ajánlott. Az MR- vagy számítógépes tomográfia a térfogatvizsgálathoz használható, attól függően, hogy az egyes kórházakban milyen készülékek vagy számítógépes programok állnak rendelkezésre. Ha kétség merül fel a nyirokcsomókba való terjedéssel kapcsolatban, ami ellenjavallhatja a műtétet, pozitronemissziós tomográfia vagy finom tűs aspirációs endoszkópia javasolt.
Nem gyógyíthatósági kritériumok
A PHC egyetlen gyógyító kezelése a műtét, és ez biztosítja a legjobb hosszú távú túlélést. A sebészi reszekcióra elfogadott kritériumok az elmúlt években kibővültek a Memorial Sloan Kettering Cancer Center munkatársai, Burke és munkatársai31 által 1998-ban kezdetben leírtaktól egészen az érresekciót és kiterjesztett hepatektómiát alkalmazó megközelítések közelmúltbeli bevezetéséig.3,5,32-34 A nem reszekálhatóság kritériumai kórházanként eltérőek, és a legelterjedtebbek a következők: az egyik oldal érrendszeri érintettsége kontralaterális epeérintettséggel a másodfokú radikálisok felosztásáig, távoli májmetasztázisok, mindkét májlebeny érrendszeri érintettsége, extrahepatikus vagy peritoneális érintettség, valamint a celiakustörzs, a felső mesenterialis artéria vagy a paraaorta régió adenopátiás érintettsége.3,5,8,31.
A De Jong és munkatársai által közzétett multicentrikus vizsgálatban34 , amelyben 305, az USA és Európa 7 különböző központjában PHC miatt operált beteget elemeztek, és amelybe portális érintettségű betegek is beletartoztak, a többváltozós elemzésben az egyetlen 2 statisztikailag szignifikáns prognosztikus tényező a reszekciós margó érintettsége és a nyirokcsomó érintettség volt (P=.02). Az Ebata és munkatársai által közzétett tanulmányban15 , amelyben 8 japán kórházban 1352, gyógyító szándékkal PHC miatt operált beteget elemeztek, a statisztikailag szignifikáns prognosztikai faktorok többváltozós elemzése a következőket mutatta ki: érinvázió, a hasnyálmirigy inváziója, nyirokcsomó érintettség, metasztázis jelenléte és a reszekciós margó érintettsége. A nyirokcsomó érintettség és az áttétképződés voltak azok a tényezők, amelyek a többi tényezőhöz képest rosszabb 5 éves túlélést eredményeztek (10%, 20%, illetve 63%). Ezek az eredmények támogatják a műtét alkalmazását ezeknél a daganatoknál, ha a helyi kiterjedés ellenére lehetséges R0 reszekciót végezni, tekintettel arra, hogy a túlélés 5 évre növelhető a helyi kiterjedéstől függetlenül.
A fenti megfontolások miatt ajánlott minden esetet egyénileg értékelni, és a műtétet akkor alkalmazni, ha távoli áttét vagy peritoneális érintettség hiányában elérhető az R0 reszekció. A kétoldali epeúti és helyi érrendszeri érintettség ezért nem lehet a nem-operálhatóság kritériuma, ha a májtérfogat több mint 30%-ának megőrzése és az onkológiai reszekció elérése mellett lehet operálni.
Terápiás stratégiákEpeúti drenázs
Mivel a PHC-s betegek többsége sárgasággal debütál, az egyik legfontosabb dilemma a preoperatív epeúti drenázs hasznosságával kapcsolatos. Ez azonban nem mentes a szövődményektől, és a sztent behelyezésével járó ERCP-hez kapcsolódó szövődmények a következők: pancreatitis, duodenalis perforáció, duodenalis migráció, katéterelzáródás és – ami a legfontosabb – cholangitis. A CTPH-val történő drenázs kisebb gyakorisággal jár a preoperatív cholangitisszel, de vérzéssel, katétervándorlással, a katéter pályáján belül akár 5%-ban tumor disszeminációval, valamint a belépési zónában kellemetlen érzéssel és fájdalommal jár. Összességében a publikált tanulmányok szerint az ERCP társuló morbiditása 60%, a CTPH esetében pedig 31%.14,35
A fenti okok miatt megkérdőjelezték a preoperatív epedrenázs hasznosságát a hepatobiliopankreatikus műtétekben.36,37 Ezek a tanulmányok, amelyek a hepatobiliáris műtétek valamennyi típusára kiterjednek, kimutatták, hogy a sárgaságban szenvedő betegeknél a preoperatív epedrenázs növeli a társuló morbiditást anélkül, hogy javítaná a túlélést, elsősorban a fertőzésekkel járó szövődmények növekedésével. A Farges és munkatársai által 2013-ban publikált európai multicentrikus tanulmány38 366 olyan beteget elemzett retrospektíven, akiket PHC miatt hepatektómiának vagy kiterjesztett hepatektómiának és epeúti reszekciónak vetettek alá. Aszerint osztályozták őket, hogy végeztek-e preoperatív epedrenázst vagy sem. A műtét előtti drénezés nélküli csoportba (non-PBD) 186 beteg tartozott, az epeúti drénezéses csoportba (PBD) pedig 180 beteg. A csoportok homogének voltak az életkor, a tumor stádiuma és a portális reszekció tekintetében. A PBD-csoportban több jobb oldali hepatektómia történt (56% vs. 44%). Amikor a két csoportot az elvégzett műtét típusa szerint hasonlították össze, a jobb oldali hepatektómián átesett betegeknél nagyobb volt a posztoperatív májelégtelenség előfordulása, ha a nem PBD-csoportba tartoztak, a PBD-csoportban 16%, míg a PBD-csoportban 4% (P=,009). A jobb oldali hepatektómiás csoportban a magasabb mortalitással összefüggő tényezők többváltozós elemzésében statisztikailag szignifikáns tényező volt a műtét előtti 3 mg/dl alatti bilirubinszint. Ha azonban a bal oldali hepatektómiás betegek mindkét csoportját összehasonlítottuk, a PBD-csoportban magasabb volt a posztoperatív szepszis előfordulása: 6%, míg a nem PBD-csoportban 0% (P=.014). Ez a vizsgálat azt mutatja, hogy bár igaz, hogy az epedrenázs növeli a posztoperatív szepszis előfordulását, az epedrenázst azoknál a betegeknél kell elvégezni, akiknél jobb oldali hepatektómiára kerül sor a posztoperatív májelégtelenséggel járó morbimortalitás csökkentése érdekében, és más tanulmányok is alátámasztják ezt az elméletet.39 Tekintettel arra, hogy a PHC kezelésében csak azok a tanulmányok mutattak ki nagyobb túlélést, amelyek az R0 reszekció elérése érdekében végzett kiterjedt reszekciókat támogatják, az epeúti drenázs akkor javasolt, ha a műtét indikált, és esetleg a májtérfogat több mint 50%-át érintő kiterjedt hepatektómiát vagy trisegmentektómiát igényel, vagy ha cholangitis áll fenn. Vitatott a bilirubinszint határértéke, amely a drenázs indikációjául szolgál, és a >10mg/dl az egyik legszélesebb körben használt érték.5,37 Ajánlott az epeúti drenázs CTPH-val történő elvégzése, külső drenázs beültetésével, amellyel elkerülhető a daganat manipulálása. Így a fertőzések előfordulása alacsonyabb, mint a CPRE-nél, és lehetővé teszi, hogy azoknál az egyoldali drénezéssel ellátott betegeknél, akiknél nem normalizálódik a bilirubinszint, kétoldali epeúti drénezést alkalmazzanak.35,40
Tumor disszeminációt írtak le a szúrás helyén a CTPH-t alkalmazó esetek akár 5-10%-ában,14,24 bár ezek a tanulmányok nem részletezik, hogy külső vagy belső-külső drénezést alkalmaztak, és nem veszik figyelembe a műtétig eltelt időt. Egyes szerzők az endoszkóposan elhelyezett nazobiliáris drenázs alkalmazását javasolják a szúrás helyén történő disszemináció megelőzésére, amelynél az epehólyaggyulladás és a stent elzáródásának előfordulása alacsonyabb, mint a CPRE esetében.41 Ugyanezek a tanulmányok azonban elismerik az e rendszerrel végzett preoperatív kétoldali epedrenázs nehézségeit, és ez akadályozza a műtét előtti bilirubinszint normalizálását azoknál a betegeknél, akiknél az egyoldali drénezés nem sikerült.42
A preoperatív epedrenázst követő fertőzésekkel kapcsolatos morbiditás csökkentése érdekében javasolják az epe szisztematikus tenyésztését a drénezést követően és a műtét alatt. Számos tanulmány kimutatta, hogy e tenyészetek 78-94%-a pozitív a lecsapolt betegek esetében, szemben a le nem csapolt betegek 20-30%-ával,43-45 és az enterococcus a leggyakrabban izolált organizmus. Ezek a csoportok védelmezik a profilaktikus antibiotikumok alkalmazását, amelyek bár növelik az izolált fajok antibiotikum-rezisztenciáját, a publikált tanulmányokban kimutatták, hogy ezzel a műtét utáni fertőzések morbiditása hasonló a le nem drénezett csoportokéhoz. A kiválasztott antibiotikum a tenyészettől és az antibiogrammtól függ, bár a csoportok többsége legalább harmadik generációs cefalosporint vagy fluorokinolon+metronidazolt alkalmazott, ha nem állt rendelkezésre tenyésztés, vagy ha az negatív volt.43,44,46
Palliatív epedrenázst alkalmaznak olyan betegeknél, akiknél nem lehet reszekciót végezni. A drenázs történhet ERCP-vel, bevonatos fémstentet hagyva, vagy CTPH-val azokban az esetekben, amikor ERCP-vel nem lehet mindkét epeút megfelelő drenázsát elérni.
Ezért véglegesen a preoperatív epedrenázst kell alkalmazni minden olyan betegnél, akinek a bilirubinszintje 10 mg/dl feletti vagy azzal egyenlő, és azoknál, akiknél a májtérfogat 50%-ánál nagyobb mértékű lesz a májresekció. A megközelítés típusa a kórháztól függ, bár a tumor manipulációjának elkerülése és a cholangitis kisebb előfordulása miatt a CTPH külső drénezéssel javasolt. Egyes szerzők azt javasolják, hogy a lecsapolt betegek az epekultúrájuknak megfelelő profilaktikus antibiotikumokat kapjanak.
Preoperatív portál embolizáció
A preoperatív portál embolizációt az 1980-as években írták le, kezdetben Makuuchi és munkatársai47 , majd Kinoshita és munkatársai.48 A portál embolizáció célja a fennmaradó májtérfogat növelése azokban az esetekben, amelyekben azt a preoperatív volumetria elégtelennek ítélte, csökkentve a posztoperatív májelégtelenség valószínűségét. A Higuchi és Yamamoto49 által nemrégiben közzétett metaanalízisben, amely 836 olyan PHC-s beteget vizsgált, akiknél preoperatív portális embolizációt végeztek, a morbiditás 1%, a mortalitás pedig 0,09% volt. A tumor progressziója az eljárás során, amely megakadályozta a műtétet, 19,4%-ot tett ki. Ezek az eredmények alátámasztják, hogy a PHC-ben való alkalmazása indokolt azoknál a betegeknél, akiknél a preoperatív májtérfogat 30%-nál kevesebb maradt.
Staging laparoszkópia
A nem invazív képalkotó vizsgálatok érzékenységének és specificitásának az utóbbi években bekövetkezett fejlődésével a staging laparoszkópia egyre inkább háttérbe szorul. A nem operálhatóság legfontosabb kritériumai a nyirokcsomó érintettség, az epeúti kiterjedés és az érinvázió. Ezeket nehéz megítélni a laparoszkópia során, amelynek pontossága és hatékonysága évek óta csökken. Ezt mutatja Rotellar és Pardo50 közelmúltbeli felülvizsgálata, amelyben a pontosság és a hatékonyság 2002-ben 41% és 72% volt, a 2011-ben közzétett tanulmányokban pedig 14% és 32%. Ez a csökkenés elsősorban a nem invazív vizsgálatok, például az MR-kolangiográfia fejlődésének köszönhető. A hatékonysága nő, ha olyan betegeket választanak ki, akiknél nagy a peritoneális disszemináció vagy májmetasztázis kialakulásának kockázata, ezáltal megelőzhető a szükségtelen laparotomia.50-52 A nem invazív képalkotó technikák alkalmazása javasolt olyan előrehaladott stádiumokban (T2/3/4), amelyekben a peritoneális vagy nyirokcsomó érintettség előrehaladott lehet, és amelyek nem szúrhatók meg echo-endoszkópiával a preoperatív epedrenázs kialakítása előtt. Mindig intraoperatív ultrahangvizsgálattal végzett staging laparoszkópiát végzünk, hogy javítsuk a lokoregionális és nyirokcsomó érintettségre vonatkozó érzékenységet.53
Sebészeti kezelés
A műtét még mindig az egyetlen kuratív kezelés a PHC-ben,3,14 és 5 év alatt 20%-40%-os túlélési arányt ér el (2. táblázat).10,11 A sebészeti reszekciót mindig el kell végezni, ha lehetőség van R0 reszekció elérésére. A műtétet követő túlélést befolyásoló fő tényezők a reszekciós peremek érintettsége, akár mikroszkóposan (R1), akár makroszkóposan (R2), valamint a nyirokcsomók érintettsége (N1 és N2).14,17,44,54 Számos tanulmány kimutatta, hogy a túlélés nő, ha a reszekciót negatív peremek kialakítása érdekében kiszélesítik.3,5,33,45 A javasolt technikák közé tartozik a kiterjesztett hepatektómia a caudatum szegmens reszekciójával, az epeúti reszekció, a hilaris lymphadectomia a celiakustörzsig és a hepatojejunostomiával történő rekonstrukció.
Túlélés a PHC rezekcióját követően a publikált sorozatok szerint.
| Author | Egy év | Egy eset | Túlélés 5 év alatt (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20.2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Túlélés perihilaris cholangiocarcinoma miatt végzett májresekciót követően.
Csak 2 éves követés.
A “no-touch technikát” először Neuhaus és munkatársai írták le.32 a hepatikus hilum blokkrezekcióját jelenti a tumor manipulálása nélkül, ami az esetek több mint 15%-ában 5 évre növeli a betegek túlélését.3,33,34,55 Ez a technika alapvetően a portális véna és a jobb májartéria rezekciójából áll, amikor azok közel vannak a tumorhoz, ezáltal megakadályozva annak disszekcióját, ha ez a tumor manipulálásával járna, valamint a teljes epeúti rezekcióból, széles limfadenektómiával a cöliákustörzs tövéig és hepatikojejunosztómiás rekonstrukcióval. Előnyösebb lesz a jobb májlebeny kiválasztása (Neuhaus szerint az alapvető “érintésmentes technika”),33 azzal a feltétellel, hogy a tumor kiterjedése lehetővé teszi a daganathoz legközelebb eső jobb májartéria bevonását. Ez a fajta radikális műtét a posztoperatív morbiditás elfogadható arányához vezet, amely a szóban forgó sorozattól függően 50%-70%, a mortalitás pedig 10%-20%.3,5 A PHC-betegek 5 éves túlélése 20-40%, míg a portalis reszekciót is tartalmazó publikált tanulmányok és a “no-touch technikát” alkalmazó sorozatok 58%-ot érnek el 5 év alatt (2. és 3. ábra).3,5,33
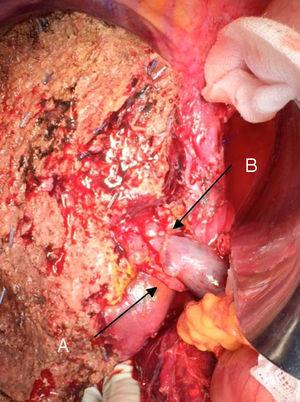
Baloldali hepatektómia Klatskin-daganat miatt, a portális véna reszekciójával: (A) a felső mesenterium jobb oldali májartériája; (B) a kapuvéna.
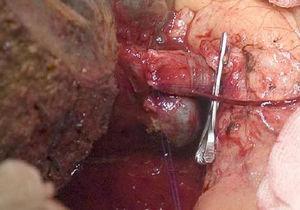
Jobb oldali hepatektómia a portális véna rekonstrukciójával.
Az újabb tanulmányokat is fontos kiemelni, amelyek a portális rezekciót követően a preoperatív érérintettségű betegek túlélésének növekedését mutatják. Sőt, olyan túlélési arányokat érnek el, amelyek megegyeznek vagy magasabbak, mint a preoperatív érérintettség nélküli, ezért portális reszekciónak nem alávetett betegeké.33,56,57 Ezekben a tanulmányokban a máj- és érrendszeri szövődmények előfordulása hasonló a portális reszekció nélküli csoportéhoz, kivéve az artériarezekciónak alávetett betegek esetében, mivel ezeknél a betegeknél magasabb a morbimortalitás, mint a többieknél. Mindezen megfontolások miatt azoknál a betegeknél, akiknél a preoperatív vizsgálatokban egyoldali portális érintettség vagy az összefolyó érintettsége mutatkozik, en-bloc reszekció és érrekonstrukció elvégzése javasolt. Az artériás rezekció és rekonstrukció csak akkor javasolt, ha az artéria egyértelműen érintett, mivel ez rosszabb posztoperatív kimenetellel jár, így ilyen esetekben a jobb oldali hepatektómia előnyösebb.
Összefoglalva, a követendő műtéti alapelvek a következők lesznek: radikális műtét epe- és csípőérrezekcióval és nyirokcsomó-eltávolítással, R0 margóval és a daganat manipulálása nélkül, még akkor is, ha ez a kapuvéna és a májartéria rezekcióját és rekonstrukcióját jelenti.
Következtetések
A jelenlegi egyetlen kuratív kezelés a sebészi rezekció. A radikális en-bloc reszekció és érrekonstrukció az a technika, amellyel hosszú távon a legmagasabb túlélési arányt sikerült elérni. A posztoperatív morbimortalitás csökkentése érdekében a májelégtelenség megelőzése érdekében ajánlott az epeúti drenázs elvégzése, a drenázs után antibiotikum-profilaxissal és portális embolizációval, ha a jövőben megmaradó májtérfogat kevesebb, mint 30%. Az R0 reszekció, a nyirokcsomó érintettség és a távoli metasztázis még mindig a legfontosabb prognosztikai tényezők.
Interdekütközések konfliktusa
Ezt a felülvizsgálatot nem mutatták be, illetve nem tették közzé részben vagy egészben egyetlen folyóiratban vagy kongresszuson sem.
Ez a felülvizsgálat nem került bemutatásra vagy közzétételre.