A kémia segít megérteni a minket körülvevő világ tulajdonságait és összetételét. Itt megismerheted az anyagállapotokat, valamint sok mindent megtudhatsz egy bizonyos állapotról (háromszor kitalálod – nem szilárd vagy folyékony…).
Az anyagállapotok
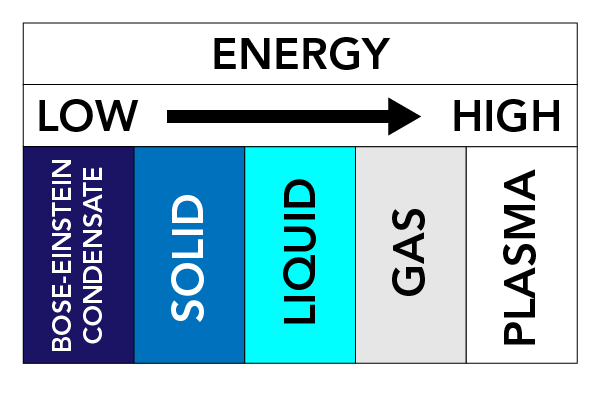
A hőmérséklet, a nyomás és az anyag tulajdonságaitól függően egy anyag különböző fizikai formákat vehet fel. Ezeket a fizikai formákat anyagállapotoknak nevezzük. Három nagyon jól ismert halmazállapot létezik: A szilárd anyagok, a folyadékok és a gázok. Léteznek más halmazállapotok is. Ezek közé tartozik a plazma (a gázokhoz hasonló anyagállapot, de szabadon mozgó elektronokat és ionokat – elektronokat vesztett atomokat – tartalmaz) és a Bose-Einstein-kondenzátumok (BEC) (anyaghullámok, amelyek egyes atomtípusoknál szuperhideg hőmérsékleten fordulhatnak elő).
A részecskék közötti erők és a részecskékre ható nyomás együtt tartja a részecskéket. Ha felmelegítjük az anyagot (energiát adunk hozzá), a részecskék gyorsabban mozognak, és hajlamosak széthúzódni. A részecskéknek ez a mozgása nagy hatással van az anyag állapotára.
Szilárdtestek
A szilárdtestekben a részecskéket összetartó erők viszonylag erősek, és a részecskék nagyon közel maradnak egymáshoz. A részecskék rezeghetnek, de nem nagyon mozognak. Ezért a szilárd testek kemények és merevek. Magukra hagyva a szilárd testek megtartják alakjukat.
Folyadékok
A folyadékokban a részecskék közötti erők gyengébbek, mint a szilárd testekben. A részecskék még mindig meglehetősen közel vannak egymáshoz, de szabadon mozoghatnak. A folyadékok egy tartályban áramolhatnak, és nincs meghatározott, rögzített alakjuk.
Gázok
A gázokhoz nehéz viszonyulni, mert gyakran láthatatlanok, de mindenütt megtalálhatóak. Érezni lehet őket, amikor például a szél fúj. Néha érezzük a szagukat, amikor például főtt étel szagát érezzük, vagy amikor egy görényt feldühítettek. Egyes gázok fontosak az egészségünk szempontjából (pl. az oxigén), míg mások halálosak lehetnek (pl. a kénhidrogén és a klór). Műtét előtt érzéstelenítő gázt kaphat, amely vegyi anyagokat tartalmaz, hogy enyhítse a fájdalmat és eszméletlenné tegye a beavatkozás alatt. A gázok a robbanások erejéért is felelősek. Nézzük meg közelebbről a gázokat.
Gázok fajtái
Vannak elemi gázok (egyetlen elemből állnak) és olyan gázok, amelyek vegyületek (egynél több elemből állnak). Az elemi gázok szimbólumai bármelyik periódusos rendszerben megtalálhatók. Ezeket az alábbi táblázatban foglaljuk össze.
Diatomos gáz |
Kémiai képlet |
Monatomos Gáz |
Kémiai képlet |
|
Hidrogén |
H2 |
Hélium |
He |
|
Oxygen |
O2 |
Neon |
Ne |
|
Nitrogén |
N2 |
Argon |
Ar |
|
Fluorin |
F2 |
Kripton |
Kr |
|
Klór |
Cl2 |
Xenon |
Xe |
A kétatomos gáz olyan gáz, amelyben az alapegység egy molekula, amely két atom összekapcsolódásából áll. Az egyatomos gáz olyan gáz, amelynek alapegysége egyetlen atom. A legtöbb gáz azonban olyan vegyület, amelyben két vagy több különböző elem kémiailag egyesül. A leggyakoribb ilyen a vízgőz, a H2O. Íme néhány összetett gáz neve, képlete és felhasználása:
Közönséges név |
Kémiai képlet |
Hol van általában megtalálható |
|
Szén-dioxid |
CO2 |
Légkör, autók kipufogógáza, pop, a tüdőnk |
|
propán |
C3H8 |
grillek, tábori tűzhelyek, egyes járművek üzemanyaga |
|
Metán |
CH4 |
Az üvegházhatású gázok összetevője. gáz és földgáz |
|
Ammónia |
NH3 |
Trágyák előállítására használják, tisztítószerek előállítása |