Alyssa Cecchetelli és Lukas Morgan
A modellorganizmusok a kutatók által világszerte használt létfontosságú eszközök. Ezek az organizmusok sok génben osztoznak az emberrel, könnyen fenntarthatók a laboratóriumban, és rövid generációs idővel rendelkeznek, ami megkönnyíti a genetikai manipulációk hatásainak vizsgálatát. Ebben a blogbejegyzésben öt népszerű modellorganizmussal foglalkozunk, de ennél sokkal több is létezik.
A házi egér (Mus musculus)
 Kezdjük a sok kutató által leginkább kedvelt emlős modellorganizmussal: az egérrel (Mus musculus). Az egerek számos előnnyel rendelkeznek a tudósok számára emlős modellszervezetként, mivel az emlősökhöz képest viszonylag rövid, körülbelül 10 hetes generációs idővel rendelkeznek – a születés és a szülés közötti idő. A felnőtt egerek akár háromhetente is szaporodnak, így a tudósok egyszerre több egérgenerációt is megfigyelhetnek.
Kezdjük a sok kutató által leginkább kedvelt emlős modellorganizmussal: az egérrel (Mus musculus). Az egerek számos előnnyel rendelkeznek a tudósok számára emlős modellszervezetként, mivel az emlősökhöz képest viszonylag rövid, körülbelül 10 hetes generációs idővel rendelkeznek – a születés és a szülés közötti idő. A felnőtt egerek akár háromhetente is szaporodnak, így a tudósok egyszerre több egérgenerációt is megfigyelhetnek.
Mivel az egerek genetikailag és fiziológiailag jobban hasonlítanak az emberhez, mint sok más modellorganizmus, gyakran használják őket emberi betegségek tanulmányozására. Az egerek betegségei számos, az emberi betegségekhez hasonló fenotípust mutatnak, és sikeresen segítették a kutatókat különféle terápiák kifejlesztésében. Például sok tudós használ egereket olyan betegségek tanulmányozására, mint a rák, mivel az egerek jobban reprodukálják a rákos sejtek, a terápiás gyógyszerek és a szervezet többi része közötti összetett kölcsönhatásokat, mint a más modellszervezeteken vagy sejtkultúrákban végzett vizsgálatok. Scott Lowe laboratóriuma például egereket használt fel annak tanulmányozására, hogy a leukémia különböző mutációi hogyan hatnak a különböző kezelési sémákra (Zuber et al., 2009). A leukémiában előforduló különböző mutációkat hordozó retrovírus vektorok egerekbe történő befecskendezésével a Lowe-labor képes volt azonosítani egy sor olyan mutációt, amelyek a rákos sejteket ellenállóbbá tették a kemoterápiával szemben. Ezek a plazmidok megtalálhatók az Addgene-nél.
Az egerek mint modellorganizmusok másik előnye, hogy genetikailag jól kezelhetőek. Az egerek könnyen manipulálhatók olyan eszközökkel, mint a CRISPR, hogy transzgenikus vonalakat hozzanak létre.
A gyümölcslégy (Drosophila melanogaster)
 A másik népszerű modellorganizmus a Drosophila melanogaster, vagy ahogy közismertebb: a gyümölcslégy. A gyümölcslégyet már több mint egy évszázada használják a tudományos kutatásokban, de a Drosophila-kutatás “atyjaként” ismert Thomas Hunt Morgan hozta előtérbe. Morgan a gyümölcslégy segítségével fedezte fel, hogy a gének a kromoszómákon belül találhatók, jóval azelőtt, hogy egyáltalán tudtuk volna, hogy a DNS genetikai anyag (Jennings, 2011).
A másik népszerű modellorganizmus a Drosophila melanogaster, vagy ahogy közismertebb: a gyümölcslégy. A gyümölcslégyet már több mint egy évszázada használják a tudományos kutatásokban, de a Drosophila-kutatás “atyjaként” ismert Thomas Hunt Morgan hozta előtérbe. Morgan a gyümölcslégy segítségével fedezte fel, hogy a gének a kromoszómákon belül találhatók, jóval azelőtt, hogy egyáltalán tudtuk volna, hogy a DNS genetikai anyag (Jennings, 2011).
A gyümölcslégy nagyszerű modellorganizmus, mert könnyen és olcsón tenyészthető és tartható a laboratóriumban, életciklusa rövid, 8-14 nap, és nagyszámú utódot hoz létre, amelyeket külsőleg raknak le. A gyümölcslegyek genetikailag is viszonylag könnyen manipulálhatók. A tudósok mindössze 6 hét alatt tudnak új légyvonalat létrehozni, szemben a transzgenikus egérvonalak hónapokig tartó előállításával. Az évek során a légy ideális modellorganizmussá vált egy sor téma tanulmányozására, beleértve a fejlődést, a genetikát és az idegrendszert. A légy emellett fontos humán betegségmodellé vált, amely potenciálisan alkalmas terápiás gyógyszerek felfedezésére, mivel becslések szerint az emberben a betegséget okozó gének 75%-ának van funkcionális homológja a légyben (Pandey és Nichols, 2011).
A gyümölcslégy használatának hatalmas előnye a genetikai eszközök, például a GAL4/UAS és a LexA rendszer, amelyek lehetővé teszik a tudósok számára, hogy könnyen szabályozzák a kívánt gén szintjét és tér-időbeli kifejeződését. A génexpresszió ilyen típusú ellenőrzése más modellrendszerekben is lehetséges, de meglehetősen nehézkes és időigényes lehet. A GAL4/UAS-t először 1993-ban írta le Norbert Perrimon laboratóriuma, és azóta folyamatosan fejlesztették. Ha érdekelnek ezek a rendszerek, nézd meg Gerald Rubin laboratóriumát, aki olyan moduláris vektorok készletét hozta létre, amelyekkel optimálisan szabályozható a génexpresszió a légy meghatározott sejtjeiben (Pfeiffer et al., 2010).
Élesztőgomba (Saccharomyces cerevisiae)
 A tudományos kutatásban gyakran használt modellorganizmus az egyik legegyszerűbb eukarióta szervezet. Igen, ugyanazt a fajtát használjuk a kenyérben és más pékárukban! Az élesztő olcsó, egyszerű és könnyű vele dolgozni, mivel a legkülönbözőbb környezeti körülmények között is képes túlélni, és 2 óránként megduplázódik. Az élesztő az első eukarióta genom, amelyet teljes egészében szekvenáltak, és nagyon alkalmas a genetikai manipulációra.
A tudományos kutatásban gyakran használt modellorganizmus az egyik legegyszerűbb eukarióta szervezet. Igen, ugyanazt a fajtát használjuk a kenyérben és más pékárukban! Az élesztő olcsó, egyszerű és könnyű vele dolgozni, mivel a legkülönbözőbb környezeti körülmények között is képes túlélni, és 2 óránként megduplázódik. Az élesztő az első eukarióta genom, amelyet teljes egészében szekvenáltak, és nagyon alkalmas a genetikai manipulációra.
Az élesztősejtek nemcsak a fenti okok miatt nagyszerű modellorganizmusok, hanem azért is, mert valójában számos biológiai tulajdonságuk és folyamatuk megegyezik a saját sejtjeinkkel. Az emberi sejtekhez hasonlóan az élesztő DNS kromoszómákba van csomagolva, és az élesztőgének körülbelül 23%-ának van megfelelője az emberben (Liu et al., 2017) . Így az élesztő felhasználható az emberi betegségek molekuláris alapjainak tanulmányozására, amelyeket egy adott gén okoz. Például számos emberi rákban mutálódott génnek van homológja, amely részt vesz az élesztő sejtosztódásban (Pray, 2008). Az élesztőn végzett tudományos felfedezések ezután tovább tanulmányozhatók más modellorganizmusokon, amelyek jobban reprodukálják az emberhez hasonló in vivo körülményeket.
Az élesztő például egyszerűségének köszönhetően fontos kísérleti modellé vált a neurológiai betegségek, például a Parkinson-kór (Parkinson-kór) tanulmányozásában. A Parkinson-kórra elsősorban a fehérjék félrecsúszása jellemző, ami az agyban “lewy-testeknek” nevezett fehérjeaggregátumok felhalmozódásához vezet. A Parkinson-kór élesztőmodelljei, például azok, amelyek túlreprezentálják a toxikus α-szinuklein fehérjét (a lewy-testekben leggyakrabban előforduló fehérjét), felbecsülhetetlen értékűek a betegség hátterében álló alapvető molekuláris mechanizmusok megértésében (Menezes és mtsai., 2015). Mivel az élesztő egysejtű élőlények, egy kísérletben több terápiás vegyület egyszerű szűrésére is alkalmasak.
Zebrahal (Danio rerio)
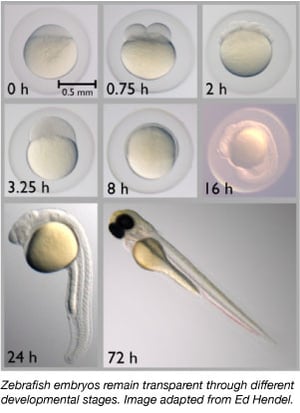 Az 1960-as évek óta a zebrahal fokozatosan fontos modellszervezetté vált. Génjeik mintegy 70%-án osztoznak az emberrel, és a betegséggel összefüggésbe hozott emberi gének 85%-ának van homológja a zebrahalban (Howe et al., 2013). A zebrahalak kicsik, könnyen tarthatók, mivel nagy csoportokban tartják őket, könnyen tenyészthetők, és egyszerre 50-300 ikrát hoznak létre. A zebrahal embriókat külsőleg is lerakják és megtermékenyítik, így a tudósok könnyen manipulálhatják őket. A tudósok egyszerűen befecskendezhetik az egysejtű embriókba a DNS-t vagy RNS-t, hogy genomjukat szerkesszék vagy transzgenikus állatokat hozzanak létre.
Az 1960-as évek óta a zebrahal fokozatosan fontos modellszervezetté vált. Génjeik mintegy 70%-án osztoznak az emberrel, és a betegséggel összefüggésbe hozott emberi gének 85%-ának van homológja a zebrahalban (Howe et al., 2013). A zebrahalak kicsik, könnyen tarthatók, mivel nagy csoportokban tartják őket, könnyen tenyészthetők, és egyszerre 50-300 ikrát hoznak létre. A zebrahal embriókat külsőleg is lerakják és megtermékenyítik, így a tudósok könnyen manipulálhatják őket. A tudósok egyszerűen befecskendezhetik az egysejtű embriókba a DNS-t vagy RNS-t, hogy genomjukat szerkesszék vagy transzgenikus állatokat hozzanak létre.
A zebrahalak ideális modellorganizmusok az embrionális fejlődés tanulmányozására, mivel embrióik teljesen átlátszóak. Így a tudósok könnyen megfigyelhetik a korai fejlődési szakaszokat, ami más gerinces fajoknál nehézségekbe ütközik. Az átlátszóság azt is lehetővé teszi, hogy a tudósok könnyen megfigyelhessék a fluoreszcensen jelölt fehérjéket és szöveteket a fejlődési folyamatok jobb értékelése érdekében.
A Stainier laboratórium például a β-sejtek proliferációját és differenciálódását vizsgálta a fejlődő zebrahal hasnyálmirigyében. Először plazmidok segítségével jelölték meg ezeket a sejteket. Ezután a HOTcre módszerrel, amely hőindukciót használ a különböző transzgének időbeli kifejeződésének szabályozására, a Stainer-csoport megállapította, hogy valójában a β-sejteknek két különböző populációja létezik, amelyek a hasnyálmirigy különböző régióiból származnak, és különböző mennyiségű inzulint termelnek (Hesselson et al, 2009).
A féreg (Caenorhabditis elegans)
 A féreg, Caenorhabditis elegans, az 1970-es évek óta széles körben használt modellorganizmus, amikor Sydney Brenner behozta a laboratóriumba az idegsejtek fejlődésének tanulmányozására (Brenner, 1973). A C. elegans kisméretű, átlátszó férgek, amelyeknek gyors életciklusuk és nagyméretű fészekaljaik vannak. A C. eleganok többsége öntermékeny hermafrodita, így könnyen végezhetők nagyméretű, több generáción átívelő kísérletek. Más modellorganizmusokhoz hasonlóan a C. elegans genomja is teljesen szekvenált, és az emberi gének több mint 60%-ának van ortológja a C. elegansban, így ideális az alapvető molekuláris biológiai folyamatok tanulmányozására.
A féreg, Caenorhabditis elegans, az 1970-es évek óta széles körben használt modellorganizmus, amikor Sydney Brenner behozta a laboratóriumba az idegsejtek fejlődésének tanulmányozására (Brenner, 1973). A C. elegans kisméretű, átlátszó férgek, amelyeknek gyors életciklusuk és nagyméretű fészekaljaik vannak. A C. eleganok többsége öntermékeny hermafrodita, így könnyen végezhetők nagyméretű, több generáción átívelő kísérletek. Más modellorganizmusokhoz hasonlóan a C. elegans genomja is teljesen szekvenált, és az emberi gének több mint 60%-ának van ortológja a C. elegansban, így ideális az alapvető molekuláris biológiai folyamatok tanulmányozására.
A C. elegans is jól használható genetikai manipulációra. Transzgénikus állatok készíthetők egyszerű DNS mikroinjekcióval a féregbe, például fluoreszcens markereket expresszáló állatok (Mello et al., 1991). A gének RNS-interferenciával (RNAi) is könnyen kiiktathatók, ha a féreggel olyan specifikus plazmidokat (L4440) expresszáló baktériumokat etetünk, amelyek tartalmazzák a kívánt gént (Fire et al., 1998). Az RNAi felfedezése a féregben tulajdonképpen Nobel-díjjal jutalmazta a letéteményeseket, Andrew Fire-t és Craig Mello-t 2006-ban.
A C. elegans egyik nagy előnye, hogy egész életük során átláthatóak. Így bármilyen genetikai módosítás, például fluoreszcens fehérje kifejezése vagy egy gén megszakítása könnyen láthatóvá tehető az élő szervezetben az embrionális fejlődéstől a felnőttkorig. A sejtek és szövetek genetikai manipulálásának és vizualizálásának ez a képessége lehetővé teszi a tudósok számára, hogy in vivo vizsgálatokat végezzenek, ami más modellorganizmusok esetében meglehetősen nehézkes lehet. A férgeket számos biológiai rendszer és folyamat vizsgálatára használták, többek között az idegrendszer, a fejlődés, a sejtszignálok, az öregedés és a mechanotranszdukció vizsgálatára, hogy csak néhányat említsünk. Andrew Leifer laboratóriuma például egy genetikailag kódolt kalciumszenzort, a GCaMP6-ot expresszáló plazmidot használva a féreg segítségével a teljes felnőtt agyban zajló kalciumszignalizációt tanulmányozta (Nguyen et al., 2015). Ha érdeklik a C. elegans plazmidok és erőforrások, nézze meg az Addgene Worm Expression oldalát.
Még több modellorganizmust keres? Nézze meg a népszerű modellorganizmusok sorozat második részét, és olvasson a feltörekvő modellorganizmusok számára kifejlesztett új rendszerekről!
Brenner, Sydney. “A Caenorhabditis elegans genetikája”. Genetics 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. “Distinct populations of quiescent and proliferative pancreatic β-cells identified by HOTcre mediated labeling”. Proceedings of the National Academy of Sciences 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. “The zebrafish reference genome sequence and its relationship to the human genome”. Nature496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. “Drosophila-a sokoldalú modell a biológiában & orvostudományban”. Materials today 14.5 (2011): 190-195.
Mello, Craig C., et al. “Hatékony géntranszfer C. elegansban: extrachromoszómális fenntartás és a transzformáló szekvenciák integrációja”. The EMBO journal 10.12 (1991): 3959-3970. PubMed PMID: 1935914. PubMed Central PMCID: PMC453137.
Nguyen, Jeffrey P., et al. “Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans.” (“Egész agyi kalcium képalkotás celluláris felbontással szabadon viselkedő Caenorhabditis elegansban”). Proceedings of the National Academy of Sciences 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan és Charles D. Nichols. “Humán betegségmodellek Drosophila melanogasterben és a légy szerepe a terápiás gyógyszerkutatásban”. Gyógyszerészeti áttekintések 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.
.