- Introdução
- Métodos
- Fibroblastos de camundongos
- Diagnóstico e medicamentos para pacientes
- Retiro experimental
- Medição do Período Refratário Efetivo
- Stock Solutions and Drug Application
- Análise dos Parâmetros do Potencial de Ação
- Análise estatística
- Resultados
- Efeitos do MK-0448 sobre Kv1.5 Corrente
- Efeitos do MK-0448 sobre os potenciais de ação
- Discussão
- Limitações do estudo
- Conclusão
- Conflict of Interest Statement
- Acknowledgments
Introdução
Em busca de medicamentos antiarrítmicos mais seguros para o tratamento da fibrilação atrial (FA), Os inibidores selectivos do IKur foram concebidos como agentes antiarrítmicos atriais selectivos classe III com potencial terapêutico na FA. Uma vez que visam os canais Kv1.5 que só funcionam nos átrios (Mays et al., 1995), estes agentes são considerados desprovidos de efeitos proarrítmicos nos ventrículos e por isso têm recebido muito interesse na comunidade científica (para revisão ver Ford e Milnes, 2008; Tamargo et al, 2009; Ravens, 2010; Ravens e Wettwer, 2011).
Actualizamos previamente os efeitos eletrofisiológicos de vários inibidores IKur, incluindo 4-aminopiridina, AVE0118, XEN-D0101, todos os quais elevaram a fase platô dos potenciais de ação atrial direita humana (PAs) registrados em trabéculas de apêndice atrial obtidas de pacientes em ritmo sinusal (SR) ou FA (Wettwer et al, 2004; Christ et al., 2008; Ford et al., 2013). Curiosamente, a duração potencial de ação (APD90) e período refratário efetivo (ERP) foram encurtados em SR, mas prolongados em preparações de FA.
Recentemente, resultados de primeira vez em homem com outro inibidor seletivo de Kv1.5, MK-0448 foram publicados (Pavri et al., 2012). MK-0448 não afetou o ERP atrial relativo em voluntários saudáveis, e os autores concluíram que não se pode esperar que o bloqueio IKur exerça efeitos antiarrítmicos terapêuticos úteis na FA. Como nada se sabe sobre os efeitos do MK-0448 no tecido atrial humano ex-vivo, investigamos seus efeitos sobre as formas de AP atrial e ERP com técnicas padrão de microeletrodos em trabéculas isoladas de apêndices atriais direitos de pacientes em SR e FA, que tiveram que se submeter a cirurgia cardíaca a céu aberto. Nas preparações de SR, o MK-0448 elevou o potencial do platô e encurtou o APD e ERP a 1 Hz, como esperado dos bloqueadores IKur. Também confirmamos que o MK-0448 bloqueia efetivamente a corrente Kv1.5 em fibroblastos de camundongos expressando de forma estável o gene hKCNA5.
Métodos
Fibroblastos de camundongos
HK2BN9 células expressando o gene Kv1.5 humano foram gentilmente fornecidas pelo Dr. Tamkun (Snyders et al., 1993). As células foram cultivadas no meio de águia modificado de Dulbecco contendo 10% de soro fetal de bezerro e 1% de penicilina/streptomicina sob condições atmosféricas de 5% de CO2 a 37°C. 250 μg/ml de G418 foi adicionado ao meio para seleção. A expressão de Kv1.5 foi induzida pelo tratamento das células com 1 μM dexametasona 24 h antes de uma experiência. As células foram estudadas com um único eletrodo padrão de fixação de tensão de célula inteira, como descrito anteriormente (Radicke et al., 2006). A solução de banho contida (em mM): NaCl 150, KCl 5.4, MgCl2 2, CaCl2 2.0, HEPES 10, glicose 10, pH 7.4, temperatura 25°C. A solução do eletrodo contido (em mM): KCl 40, aspartato de potássio 80, NaCl 8, CaCl2 2, MgATP 5, EGTA 5, GTP 0,1, HEPES 10, pH 7,4 ajustado com KOH. As resistências da série foram entre 5 e 10 MΩ e foram compensadas em até 85%. A capacitância celular foi medida com pequenos passos de pinça hiperpolarizante de -40 mV a -42 mV, valor médio foi 20,8 ± 1,2 pA/pF (n = 33) e não diferiu entre as células testadas a 0,5 e 3 Hz. A geração de pulsos da pinça de tensão, a coleta de dados e a análise foram realizadas com o software ISO2 (MFK, Niedernhausen, Alemanha). Os dados não foram corrigidos para o potencial de junção que era de 11,7 mV, conforme calculado com o software JPCalc (P.H. Barry, Sydney, Austrália).
Diagnóstico e medicamentos para pacientes
Tipo atrial foi obtido de pacientes que receberam cirurgia cardíaca por causa de doença arterial coronária ou valvar. Todos os pacientes deram o seu consentimento informado por escrito. O estudo foi aprovado pelo comitê de ética da Faculdade de Medicina da Universidade de Tecnologia de Dresden (No. EK790799). Os pacientes estão listados na Tabela 1. O estudo incluiu 13 medicamentos expostos e 9 preparações de TMC de pacientes em ritmo sinusal (grupo SR), 9 medicamentos expostos e 9 preparações de TMC de pacientes com fibrilação atrial permanente (grupo FA, definido como fibrilação atrial permanente para ≥6 meses no momento da coleta tecidual), e 3 preparações expostas de pacientes com FA intermitente (episódios de FA terminando espontaneamente por alguns segundos até várias horas). A medicação dos pacientes normalmente incluía inibidores da ECA, β -bloqueadores, nitratos, drogas para redução de lipídios e diuréticos.
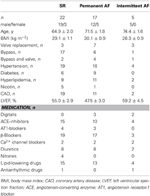
Tábua 1. Características dos pacientes cujos trabéculas foram usadas para exposição a drogas.
Retiro experimental
Peças pequenas (50-100 mg em peso) de apêndices atriais direitos humanos foram transportadas para o laboratório em uma solução especial de transporte livre de Ca2+ a 20-25°C, composição em mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgSO4, 50 taurina, 5 MOPS, 30 monoxime de 2,3-butano-diona (BDM), pH 7,0. Foram dissecadas trabéculas (<1 mm de diâmetro e 2-5 mm de comprimento) ou trabéculas juntamente com a parede atrial anexa e montadas no fundo de um banho de órgãos de 5 ml perfurado com 50 ml de solução de Tyrode recirculada e oxigenada a uma taxa de fluxo de 7 ml/min a 36 ± 1°C (composição em mM: 126.7 NaCl, 0,42 NaH2PO4, 22 NaHCO3, 5,4 KCl, 1,8 CaCl2, 1,5 MgCl2, pH 7,4 quando equilibrado com 5% de CO2 em O2). As preparações foram estimuladas eletricamente a uma taxa basal de 1 Hz com estímulos isolados de onda quadrada de 1 ms de duração, 2 vezes a intensidade do limiar. Os potenciais transmembranares foram registrados com microeletrodos de vidro preenchidos com 2,5 M KCl. As resistências das pontas dos eléctrodos estavam entre 20 e 80 MΩ. Tanto o tempo dos estímulos de condução quanto o pré-processamento das respostas dos potenciais transmembrana foram realizados com um sistema de registro de potenciais de ação auxiliado por computador (Wettwer et al., 2004). Gráfico para Windows, Versão 7.3.5, programa de gravação (ADInstruments Pty Ltd., Castle Hill, Austrália) foi usado para análise dos parâmetros do potencial de ação.
A cada experimento foi precedido por um período de 60 minutos de equilíbrio durante o qual os preparativos foram permitidos para estabilizar e o BDM residual foi completamente eliminado. Os valores numéricos dos principais parâmetros de potencial de ação tiveram que permanecer constantes, ou seja, dentro de uma faixa de ±5% por pelo menos 10 min. Quando o microeletrodo saiu da célula, um novo empalamento foi feito no mesmo local e o experimento foi continuado se o novo registro não diferisse do antigo por julgamento visual e mostrasse menos de 3% de diferença na análise numérica final.
Medição do Período Refratário Efetivo
Período refratário efetivo (ERP) foi medido por um único estímulo extra interpolado após trens de 10 pulsos de estimulação regular na freqüência basal de 1 Hz com intervalos decrescentes em passos de 5 ms desde o último pulso regular até que o estímulo extra não conseguisse eliciar um potencial de ação. Após um curto período de recuperação o preparado foi exposto ao MK-0448 (3 μM) a 1 Hz por mais 60 min e o ERP foi testado mais uma vez na presença do medicamento.
Stock Solutions and Drug Application
MK-0448 foi sintetizado pela Xention Ltd. Cambridge UK. Em alguns experimentos, MK-0448 foi aplicado em concentrações cumulativamente crescentes pela adição direta de alíquotas de uma solução de reserva de 10 mM com DMSO como solvente a 50 ml do meio de banho circulante. A concentração de DMSO nunca excedeu 0,2%, uma concentração que não induziu nenhuma mudança significativa quando aplicada isoladamente. As preparações foram expostas a cada concentração de MK-0448 durante 20 minutos.
Análise dos Parâmetros do Potencial de Ação
Foram analisados os seguintes parâmetros padrão de PA atrial: potencial de membrana em repouso, RMP (mV), amplitude do potencial de ação, APA (mV), duração do potencial de ação em 20, 50 e 90% da repolarização, APD20, APD50 e APD90 (ms), taxa máxima de despolarização, dV/dtmax (V/s) e o “potencial platô” definido como o potencial médio absoluto de membrana (mV) na janela de tempo entre 20 e 30% do APD90 (PLT20). Preparações com potenciais de repouso menos negativos que -65 mV e amplitudes abaixo de 80 mV foram descartadas.
Análise estatística
Prisma GraphPad (versão 4.03) foi utilizado para análise estatística. Nas curvas concentração-resposta (ver Tabela 2) os valores obtidos em concentrações crescentes foram comparados com os controles pré-droga pela ANOVA One-Way seguida pelo teste de comparação múltipla de Bonferroni. Os parâmetros de potencial de ação individual de SR e preparações de FA permanente na presença de 3 μM MK-0448 foram comparados aos controles pré-droga pelo teste t de Student pareado (ver Tabela 3). As diferenças são consideradas estatisticamente significativas para P < 0,05,

Tábua 2. Efeitos dependentes da concentração de MK-0448 a 1, 3 e 10μM (1 Hz).
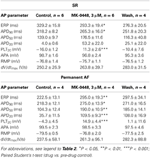
Tabela 3. Efeitos do MK-0448 (3μM) sobre os parâmetros potenciais de ação e período refratário efetivo (ERP) de trabéculas atriais direitas humanas de pacientes em SR e FA (frequência de estimulação 1 Hz).
Resultados
Efeitos do MK-0448 sobre Kv1.5 Corrente
Kv1.5 correntes, que foram medidas durante as mudanças de potencial de passo de -60 mV para vários potenciais de teste entre -40 e +80 mV tiveram um potencial limiar de -30 mV, ativados rapidamente e dificilmente inativados dentro de 500 ms (dados não mostrados). Para o teste de fármacos escolhemos 50 ms de duração de passos de pinça de tensão até +50 mV, que eliciaram amplitudes médias de corrente de 85,0 ± 10,5 pA/pF a 0,5 Hz (n = 16) e 110,6 ± 16,9 pA/pF a 3 Hz n = 17, P = 0,2133). MK-0448 (100 nM) bloqueou a amplitude de corrente Kv1,5 de uma forma dependente da frequência (Figura 1A). A 0,5 Hz, o bloco atingiu um estado estável dentro de 5-10 min da aplicação do medicamento e recuperou parcialmente durante um período de 5 min em que a célula foi continuamente pinçada a -60 mV (Figura 1B). Quando as células foram expostas ao MK-0448 durante um período de 5 min mantido a -60 mV, para manter os canais no estado fechado, o IKv1.5 do primeiro pulso pós repouso não foi diferente do pré-teste. Os pulsos subseqüentes na presença do medicamento revelaram um rápido início de inibição, aumentando a cada pulso até atingir o estado estável (Figura 1C). MK-0448 (100 nM) reduziu IKv1,5 de 82,3 ± 31,5 pA/pF para 22,4 ± 6,0 pA/pF (n = 5) dentro de 3 min de passos contínuos de fixação de tensão a 0,5 Hz, e de 113,8 ± 52,7 pA/pF para 12,9 ± 2,5 pA/pF a 3 Hz (n = 4). Estes resultados são consistentes com a inibição do MK-0448 de Kv1.5, dependendo da activação do canal.

Figura 1. Efeitos do MK-0448 sobre as correntes de Kv1.5 medidas em células HK2BN9 a 25°C. (A) Pinça de tensão e traços de corrente obtidos antes (preto) e depois da superfusão de células com 100 nM MK-0448 (verde) durante 10 min. Taxa de pulsos da pinça, conforme indicado. (B) Efeito de bloqueio de MK-0448 (100 nM) sobre o pico de corrente Kv1.5 e recuperação do bloqueio durante 5 min. no potencial de retenção de -60 mV. Os traços individuais de corrente em cima foram obtidos nos pontos de tempo indicados por letras pequenas no gráfico diário na parte inferior. (C) Efeito da droga após exposição durante 5 min de pinçamento contínuo a -60 mV. Freqüência de passos: 3 Hz.
Efeitos do MK-0448 sobre os potenciais de ação
Potenciais de ação registrados em trabéculas atriais direitas de pacientes em SR tinham a configuração típica de espigão e cúpula (Figura 2), em tecido AF permanente a forma era triangular e é o resultado de remodelação elétrica . O efeito mais marcante da MK-0448 (1-10 μM) sobre os potenciais de ação do SR na freqüência de estimulação basal de 1 Hz foi uma elevação robusta no potencial platô (PLT20) (Figura 2; Tabela 2). Neste conjunto de experimentos, os APD90 tenderam a ser encurtados (não significativos) enquanto APD20 e APD50 foram prolongados, atingindo o nível de significância estatística apenas na concentração mais alta (ver Tabela 2). O potencial de membrana em repouso (RMP), a amplitude do potencial de ação (APA) e a velocidade máxima de despolarização (dV/dtmax) não foram significativamente afetados pelo MK-0448 (ver Tabela 2). Antes e depois do tratamento medicamentoso todas as preparações seguiram a estimulação, mesmo na concentração mais alta.
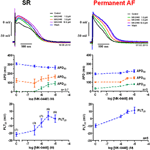
Figura 2. Efeitos dependentes da concentração de MK-0448 sobre os potenciais de ação registrados em trabéculas atriais direitas de pacientes em ritmo sinusal (SR) e fibrilação atrial permanente (FA). Topo: Traçados individuais para experimentos típicos, registrados na presença de concentrações crescentes de composto (ver código de cores). Tempo de exposição a cada concentração: 20 min; controle: controle pré-droga. Meio e fundo: Valores médios ± s.e.m. de 7 experimentos em SR e 5 em AF, de duração potencial de ação a 90, 50, e 20% de repolarização (APD90, APD50, e APD20) e potencial de platô (PLT20). Frequência de estimulação: 1 Hz. Observe que nem todas as preparações foram expostas a toda a gama de concentrações (números de preparações indicados entre parênteses).
Os efeitos do MK-0448 no ERP foram estudados apenas em 3 μM. Esta concentração produziu alterações máximas dentro de 40-50 min da aplicação do medicamento, e estas foram parcialmente reversíveis após 60 min de washout. Em 6 preparações de pacientes em SR, APD90, e ERP foram significativamente encurtados (Figura 3; Tabela 3). Efeitos similares foram observados em 2 preparações de pacientes em FA intermitente (Figura 3).
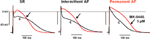
Figura 3. Efeitos da MK-0448 (3 μM, traço vermelho, seta) nos potenciais de ação registrados em trabéculas atriais direitas de pacientes em ritmo sinusal (RS), fibrilação atrial intermitente (FAI) e fibrilação atrial crônica (FA). São mostrados os registros originais de uma preparação em cada grupo. c, controle pré-droga (traço negro). Frequência de estimulação 1 Hz.
Em trabéculas de FA permanente, MK-0448 também elevou significativamente o potencial do platô em uma extensão similar à do RS, mas em contraste com o RS, APD prolongado nos três níveis de repolarização analisados (Figuras 2, 3; Tabela 3). Nas preparações de FA permanente, APA, RMP e dV/dtmax também não foram significativamente afetadas, com exceção da RMP com 10 μM MK-0448.
Por causa da disponibilidade limitada, pudemos estudar apenas os efeitos da MK-0448 em 2 trabéculas de pacientes em FA intermitente, um registro típico é mostrado na Figura 3; 3 outros foram usados como TMCs. Similar aos resultados nas preparações de SR, MK-0448 encurtou APD90 e ERP nas 2 preparações de FA intermitente.
Em experimentos de controle de tempo combinado com tecidos de pacientes em SR, FA intermitente e FA, os parâmetros potenciais de ação não mudaram significativamente (dados não mostrados).
Discussão
As mudanças características nos parâmetros potenciais de ação observados com MK-0448 no trabéculo atrial direito humano são consistentes com o bloqueio de Kv1.5 canais, como relatado anteriormente para várias drogas .
MK-0448 foi descrito como altamente seletivo para Kv1 expresso.Os canais hERG são cerca de 10.000 vezes mais sensíveis do que o Kv1.5 (Pavri et al.., 2012). Os dados da pinça de tensão em um sistema de expressão heteróloga confirmam que MK-0448 (100 nM) produziu um bloco robusto de Kv1.5 humano com um início de ação bastante lento e recuperação parcial do bloco a -60 mV. Embora nossos resultados não permitam uma caracterização precisa da interação droga-canal, eles indicam claramente que canais de repouso se recuperam do bloco e ativação são necessários para o desenvolvimento do bloco, sugerindo ligação preferencial para canais abertos e/ou inativados.
Em experimentos anteriores, demonstramos que baixas concentrações de 4-aminopiridina inibem seletivamente Iso (IKur) em miócitos atriais humanos (Wettwer et al., 2004). Este bloqueador elevou o potencial de platô nas preparações de SR (EC50~15 μM). Além disso, o 4-AP em concentrações consideradas seletivas para o bloco IKur encurtou significativamente o APD90 no SR, mas prolongou o APD90 em trabéculas AF permanentes (Wettwer et al., 2004). Os efeitos mais proeminentes do MK-0448 sobre os PA atriais humanos, ou seja elevação do potencial platô, encurtamento do APD90 no SR e prolongamento do APD20, APD50 e APD90 na FA permanente, estão em linha com nossos achados anteriores com outros inibidores IKur, de modo que estamos confiantes em concluir que a MK-0448 bloqueia de fato o IKur em trabéculas atriais humanas.
Inibição dos canais hERG, a inibição dos IKs não foi associada com um efeito proarrítmico ventricular em modelos animais (Lynch et al., 1999). Entretanto, a modulação dos IKs por MK-0448 também poderia reduzir a reserva de repolarização no ventrículo e tornar-se arritmogênica nos ventrículos sob condições apropriadas (Lynch et al., 1999). É importante notar que é difícil avaliar o risco proarrítmico ventricular de um medicamento que modula os IKs em voluntários saudáveis com reserva de repolarização ventricular normal. Portanto, a seletividade atrial do MK-0448 precisaria ser cuidadosamente avaliada nos pacientes.
O encurtamento dos bloqueadores APD90 e ERP por Kv1.5 no SR é proposto para ser causado pela elevação acentuada do potencial do platô para uma faixa de voltagem onde mais canais hERG são ativados e, embora inativados rapidamente, podem se recuperar da inativação em potenciais mais negativos e assim acelerar a repolarização final (Gintant, 2000).
Alterações distintas nas formas dos potenciais de ação, perda da taxa de adaptação do ERP e APD90 à freqüência foi reconhecida como uma marca registrada da remodelação atrial tanto em pacientes (por exemplo Attuel et al., 1982; Daoud et al., 1996) e em estudos ex vivo (Franz et al., 1997; Dobrev e Ravens, 2003). Em nosso presente estudo e no recente estudo “first-time-in-humano” com MK-0448 todos os testes eletrofisiológicos estavam em uma faixa de frequência muito abaixo da FA e pode-se argumentar que, com base em nossos dados de RS, não é surpreendente que MK-0448 não tenha prolongado a AERP em voluntários saudáveis (Pavri et al., 2012).
Experimental and clinical evidence suggests that atrial fibrillation is due to micro-reentry triggered by ectopic foci located in the proximity of the pulmonary veins (Haissaguerre et al., 1998). Intervenções farmacológicas para interrupção da micro-reentrada têm que prolongar o período refratário efetivo, enquanto a supressão de focos ectópicos requer redução da excitabilidade. Desde que o MK-0448 bloqueie de facto selectivamente o IKur, é mais provável que aumente a refracção atrial (em FA) do que reduza a excitabilidade, embora não seja claro como a elevação acentuada da amplitude do planalto se relaciona com o prolongamento do ERP em FA. Deve ser enfatizado, entretanto, que a forma geral do potencial de ação cardíaca é determinada por condutâncias múltiplas de íons, portanto a interpretação dos dados de potencial de ação não pode ser conclusiva com relação a quais canais de íons contribuem para uma determinada mudança.
No SR, observamos até um encurtamento do ERP com MK-0448 e não podemos julgar se este é um efeito anti- ou proarrítmico nos átrios. Na verdade, isto só pode ser respondido em um estudo prospectivo da Fase 2 em pacientes com FA. Entretanto, vale a pena notar que não foi relatada proarritmia para a MK-0448 (Pavri et al., 2012) ou encurtamento da AERP em voluntários saudáveis. Outros inibidores do Kv1.5, por exemplo, XEN-D0101, que foram avaliados na clínica também não relataram pro-arritmia (atrial ou ventricular) em voluntários saudáveis (Ford et al., 2013). Estudos genéticos revelaram uma associação de mutações de “perda de função” na codificação do gene KCNA5 para Kv1.5 com AF “solitária” familiar (Olson et al., 2006). No entanto, neste estudo houve genotipagem/fenotipagem incompleta de membros da família e nenhuma evidência de ligação primária. De facto, a probabilidade de observar estes dados apenas por acaso situa-se entre 10 e 15%. Um estudo recente com mais de 300 pacientes com FA precoce isolada revelou 3 mutações de “ganho de função” no KCNA5, além de várias mutações de perda de função, apoiando a hipótese de que a suscetibilidade à FA pode ser aumentada por qualquer alteração na função do KCNA5 (Christophersen et al, 2013).
Limitações do estudo
Em algumas preparações atriais humanas, a DPA não permanece estável durante a superfusão prolongada com soluções salinas (tipicamente, ~2 h).- A classificação dos pacientes em SR e FA pode nem sempre ser confiável, ou seja o grupo SR pode incluir tecido atrial de pacientes que tiveram episódios não reconhecidos de paroxística ou FA de início recente.
Conclusão
Em resumo, o bloqueador IKur MK-0448 eleva consistentemente o platô potencial de ação em trabéculas atriais humanas independentemente das formas iniciais dos potenciais de ação de controle e se as preparações foram obtidas de pacientes em SR ou FA permanente. Nas preparações de SR, o MK-0448 produziu encurtamento do APD90 e ERP, mas no tecido da FA permanente, foram observados efeitos proeminentes do APD90 e do ERP com a droga. Para a prevenção da recorrência persistente da FA, o prolongamento da ERP pelo MK-0448 nas preparações de FA é certamente um modo de ação altamente desejável que pode proteger o miocárdio atrial durante a fase de remodelamento reverso após a cardioversão, embora se, devido à modulação dos IKs, isso possa vir a ter o risco de induzir a proarritmia ventricular. Resta determinar se os medicamentos selectivos IKur (i) são mais eficazes no prolongamento da ERP a taxas atriais mais elevadas, (ii) convertem farmacologicamente a FA de início recente, (iii) reduzem a carga de FA na FA paroxística, e (iv) previnem a recorrência da FA persistente.
Conflict of Interest Statement
James Milnes e John Ford são empregados da Xention Ltd, John Ford é co-fundador e detém acções da Xention Ltd., Ursula Ravens tem actuado como consultor da Xention. Simone Loose, Judith Mueller, Michael Knaut, Erich Wettwer não têm nada a revelar.
Acknowledgments
Os autores agradecem o apoio financeiro da União Europeia (FP7-Health T2-2010-261057 “EUTRAF”) e da Xention Limited. Queremos agradecer a todos os pacientes e aos cirurgiões cardíacos Klaus Matschke e Michael Knaut pelo seu inestimável apoio, e Konstanze Fischer pela sua assistência técnica especializada.
Amos, G. J., Wettwer, E., Metzger, F., Li, Q., Himmel, H. M., e Ravens, U. (1996). Diferenças entre correntes externas de miócitos atriais e subepicárdicos ventriculares humanos. J. Physiol. 491(Pt 1), 31-50.
Pubmed Abstract | Pubmed Full Text
Attuel, P., Childers, R., Cauchemez, B., Poveda, J., Mugica, J., e Coumel, P. (1982). Failure in the rate adaptation of the atrial refractory period: its relationship to vulnerability. Int. J. Cardiol. 2, 179-197. doi: 10.1016/0167-5273(82)90032-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christ, T., Wettwer, E., Voigt, N., Hala, O., Radicke, S., Matschke, K., et al. (2008). Efeitos específicos da patologia do bloqueador I(Kur)/I(to)/I(K,ACh) AVE0118 sobre os canais iônicos na fibrilação atrial crônica humana. Br. J. Farmacol. 154, 1619-1630. doi: 10.1038/bjp.2008.209
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christophersen, I. E., Olesen, M. S., Liang, B., Andersen, M. N., Larsen, A. P., Nielsen, J. B., et al. (2013). Genetic variation in KCNA5: impact on the atrial-specific potassium current IKur in patients with lone atrial fibrillation. Eur. Heart J. 34, 1517-1525. doi: 10.1093/eurheartj/ehs442
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Daoud, E. G., Bogun, F., Goyal, R., Harvey, M., Man, K. C., Strickberger, S. A., et al. (1996). Efeito da fibrilação atrial sobre a refracção atrial em humanos. Circulação 94, 1600-1606. doi: 10.1161/01.CIR.94.7.1600
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dobrev, D., and Ravens, U. (2003). Remodelação dos canais de íons cardiomiócitos em fibrilação atrial humana. Res. Básica Cardiol. 98, 137-148. doi: 10.1007/s00395-003-0409-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J., Milnes, J., Wettwer, E., Christ, T., Rogers, M., Sutton, K., et al. (2013). Propriedades eletrofisiológicas e farmacológicas humanas do XEN-D0101: um novo inibidor atrial seletivo Kv1.5/IKur. J. Cardiovasc. Pharmacol. 61, 408-415. doi: 10.1097/FJC.0b013e31828780eb
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J. W., e Milnes, J. T. (2008). Novos fármacos visando a corrente ultra-rápida do retificador retardado cardíaco (I Kur): fundamentação, farmacologia e evidência de potencial valor terapêutico. J. Cardiovasc. Pharmacol. 52, 105-120. doi: 10.1097/FJC.0b013e3181719b0c
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franz, M. R., Karasik, P. L., Li, C., Moubarak, J., e Chavez, M. (1997). Remodelação elétrica do átrio humano: efeitos semelhantes em pacientes com fibrilação atrial crônica e flutter atrial. J. Am. Coll. Cardiol. 30, 1785-1792. doi: 10.1016/S0735-1097(97)00385-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gintant, G. A. (2000). Caracterização e consequências funcionais da corrente retificadora retardada transitória na repolarização ventricular. Am. J. Physiol. Circ. do Coração. Physiol. 278, H806-H817.
Pubmed Abstract | Pubmed Full Text
Haissaguerre, M., Jais, P., Shah, D. C., Takahashi, A., Hocini, M., Quiniou, G., et al. (1998). Iniciação espontânea da fibrilação atrial por batimentos ectópicos originários das veias pulmonares. N. Engl. J. Med. 339, 659-666. doi: 10.1056/NEJM199809033391003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lynch, J. J. Jr., Houle, M. S., Stump, G. L., Wallace, A. A. A., Gilberto, D. B., Jahansouz, H., et al. (1999). Eficácia antiarrítmica do bloqueio seletivo da corrente retificadora retardada de ativação lenta cardíaca, I(Ks), em modelos caninos de arritmia isquêmica ventricular maligna. Circulação 100, 1917-1922. doi: 10.1161/01.CIR.100.18.1917
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mays, D. J., Foose, J. M., Philipson, L. H., e Tamkun, M. M. (1995). Localização da proteína do canal Kv1.5 K+ no tecido cardíaco explantado. J. Clin. Invest. 96, 282-292. doi: 10.1172/JCI118032
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Olson, T. M., Alekseev, A. E., Liu, X. K., Park, S., Zingman, L. V., Bienengraeber, M., et al. (2006). Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation. Hum. Mol. Genet. 15, 2185-2191. doi: 10.1093/hmg/ddl143
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pavri, B. B., Greenberg, H. E., Kraft, W. K., Lazarus, N., Lynch, J. J. J., Salata, J. J., et al. (2012). MK-0448, um inibidor específico do Kv1.5: segurança, farmacocinética e eletrofisiologia farmacodinâmica em modelos animais experimentais e em humanos. Circ. Arritm. Electrophysiol. 5, 1193-1201. doi: 10.1161/CIRCEP.111.969782
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Radicke, S., Cotella, D., Graf, E. M., Banse, U., Jost, N., Varro, A., et al. (2006). Modulação funcional da corrente transitória Ito por subunidades beta KCNE e distribuição regional em corações humanos não falhados e falhados. Cardiovasc. Res, 71, 695-703. doi: 10.1016/j.cardiores.2006.06.017
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U. (2010). Terapia antiarrítmica na fibrilação atrial. Pharmacol. Ter. 128, 129-145. doi: 10.1016/j.pharmthera.2010.06.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U., and Wettwer, E. (2011). Ultra-rapid delayed rectifier channels: base molecular e implicações terapêuticas. Cardiovasc. Res. 89, 776-785. doi: 10.1093/cvr/cvq398
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Regan, C. P., Wallace, A. A., Cresswell, H. K., Atkins, C. L., and Lynch, J. J. Jr. (2006). Efeitos eletrofisiológicos in vivo de um novo óxido de difenilfosfina IKur bloqueador, (2-Isopropil-5-metilciclohexil) óxido de difenilfosfina, em rato e primata não-humano. J. Pharmacol. Exp. Ther. 316, 727-732. doi: 10.1124/jpet.105.094839
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Snyders, D. J., Tamkun, M. M., e Bennett, P. B. (1993). Um canal de potássio rapidamente activado e lentamente inactivado clonado a partir do coração humano. Análise funcional após expressão de cultura estável de células de mamíferos. J. Gen. Physiol. 101, 513-543. doi: 10.1085/jgp.101.4.513
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tamargo, J., Caballero, R., Gomez, R., e Delpon, E. (2009). I(Kur)/Kv1.5 bloqueadores de canal para o tratamento da fibrilação atrial. Opinião de especialistas. Investigação. Drogas 18, 399-416. doi: 10.1517/13543780902762850
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, Z., Fermini, B., and Nattel, S. (1993). Corrente externa induzida pela despolarização sustentada em miócitos atriais humanos. Evidência para um novo retificador retardado de corrente K+ similar às correntes de canal clonadas de Kv1.5. Circ. Res. 73, 1061-1076. doi: 10.1161/01.RES.73.6.1061
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wettwer, E., Hala, O., Christ, T., Heubach, J. F., Dobrev, D., Knaut, M., et al. (2004). Papel do IKur no controle da forma potencial de ação e contratilidade no átrio humano: influência da fibrilação atrial crônica. Circulação 110, 2299-2306. doi: 10.1161/01.CIR.0000145155.60288.71
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text