Aplicação de Sonda Multiplexa (MLPA) é uma técnica molecular desenvolvida pela MRC-Holland em 2002. Em resumo, a MLPA é uma técnica sensível que permite quantificar sequências de ácidos nucleicos, de forma rápida e eficiente. É realizada em muitos laboratórios em todo o mundo e pode ser aplicada para detectar alterações no número de cópias (como deleções ou duplicações) de um gene, identificar o estado de metilação do DNA, detectar polimorfismos de nucleotídeos únicos (SNPs) e mutações pontuais, e quantificar o mRNA. Portanto, é utilizado em muitos campos de pesquisa e diagnóstico, como citogenética, pesquisa de câncer e genética humana, entre outros.
Como funciona?
MLPA consiste nos seguintes passos (Figura 1):
- Denaturação
- Hibridação
- Ligação
- Amplificação (por PCR)
- Separação de fragmentos e análise de dados
Figure 1 – Visualização da técnica MLPA (adaptado de Schouten, Jan P., et al.1). Também podemos observar um eletroferograma típico obtido através da análise MLPA mostrando uma deleção do exon 46 (seta vermelha). (Electroferograma adaptado de https://commons.wikimedia.org/wiki/File:MLPA_in_GeneMarker.jpg)
1-Denaturação e 2 – Hibridação
Denaturação envolve a separação dos fios de ADN recozido, de modo a que o ADN de cadeia dupla se torne de cadeia simples.
Hibridação envolve a hibridação da amostra de ADN para sondas específicas. Como é uma técnica multiplex, é possível analisar cada amostra até 60 sondas em simultâneo, visando assim locais diferentes!
Estas sondas têm uma sequência de primer que se liga ao PCR-primer no processo de amplificação. Todas as sondas diferentes terão a mesma sequência de ligação de primer. Adicionalmente, as sondas também têm uma sequência de hibridação complementar ao local alvo que permitirá que a sonda se ligue ao ADN. Ambas as sondas serão hibridizadas em locais adjacentes na cadeia de DNA.
Uma das sondas do par contém uma sequência de enchimento, que é diferente em comprimento para cada local alvo. O comprimento da sequência de enchimento muda entre as diferentes sondas, permitindo a multiplexação. Assim, você pode esperar que cada produto de amplificação tenha um comprimento único!
3-Ligação
O passo de ligadura ligará as duas sondas juntas. Neste passo, é utilizada uma enzima específica chamada ligase de ADN. Ela liga as sondas que já estão hibridizadas em locais adjacentes da cadeia de DNA no local alvo. A ligase usada nos protocolos MLPA é ligase-65, uma enzima ligase dependente de NAD, que também pode ser útil em outras aplicações.
Agora, a questão permanece: se o nosso objetivo é ligar as duas sondas, por que elas separam as moléculas para começar? Bem, ambas as sondas contêm os locais de ligação para as PCR-primers. Isto significa que, se usássemos as sondas como uma única molécula, obteríamos um produto de amplificação, mesmo sem o local alvo do ADN, dando-nos assim uma amplificação não específica. A ligase enzimática é extremamente específica: se houver alguma discrepância entre a sonda e o local alvo, a ligase não será capaz de ligar as sondas e não ocorreria nenhuma amplificação. Consequentemente, o MLPA detecta mutações pontuais específicas, e até distingue entre pseudogenes e o gene alvo real.
4-Amplificação
O passo seguinte é a amplificação, que é essencialmente uma reacção polimérica em cadeia (PCR) (Tabela 1). Para a etapa de PCR, são adicionados uma polimerase, dNTPs, e um primer para a frente e para trás. Uma vez que todas as sondas têm a mesma sequência de PCR-primer, será necessário apenas adicionar um par de primers universais para estudar todos os nossos alvos. O primer forward é rotulado fluorescentemente, permitindo visualização e quantificação durante a análise.
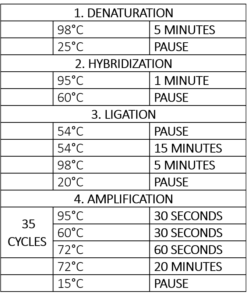
Tabela 1 – Programa Thermocycler para a reação MLPA
5- Separação de fragmentos e Análise de Dados
Após amplificação, os fragmentos são separados por eletroforese capilar. A eletroforese capilar separa os fragmentos com base em seu comprimento, e mostra fragmentos de diferentes comprimentos como padrões de pico, chamado eletroferograma (Figura 1). Cada amplicon tem um tamanho conhecido diferente, devido à seqüência de enchimento em cada sonda específica, e portanto cada amplicon pode ser quantificado durante a análise dos dados.
Os dados obtidos por eletroforese capilar serão a entrada para a análise. MRC- Holland fornece um software gratuito para análise de dados – Coffalyser.
Comparando cada amostra com um conjunto de amostras de referência, podemos obter uma relação de apalpadores. Esta relação de sondagem irá informar-nos de quantos números de cópias um gene tem. Como a maioria dos genes humanos são diplóides, se a amostra apresentar duas cópias, a razão será 1,0; ou seja, as sondas de amostra obtiveram o mesmo número de genes que a amostra de referência.
No entanto, se a razão for 0,5 houve apenas uma cópia do gene no indivíduo, o que provavelmente significa uma deleção heterozigótica do gene alvo. Se, por outro lado, a razão for 1,5, provavelmente há uma duplicação heterozigótica de um gene.
MRC-Holland oferece muitos kits diferentes que podem ter a solução para os seus problemas. No entanto, se você estiver tentando encontrar algo um pouco mais obscuro, ou estudar algo que não esteja em nenhum kit, você pode projetar suas próprias sondas. Eu o aconselho a ler cuidadosamente o protocolo para o desenho de sondas sintéticas.
Vantagens do MLPA
- MLPA é uma técnica altamente sensível, robusta e de alto rendimento.
- Pode discernir entre mutações pontuais, bem como duplicação/eliminação de genes. Portanto, ela tem uma grande vantagem sobre outras técnicas, como o sequenciamento, que só pode encontrar mutações pontuais. Além disso, ao contrário do FISH, o MLPA pode detectar pequenas alterações genéticas.
- Resultados estão disponíveis em 24 horas e por ser uma reação multiplex, permite uma rápida e eficiente coleta de informações.
- Inteligências pequenas ao protocolo MLPA podem permitir uma variedade de aplicações. Por exemplo, ao adicionar uma etapa extra de digestão, o MLPA também pode ser usado para detectar padrões de metilação no DNA (Methylation specific-MLPA (MS-MLPA)).
Limitações do MLPA
- MLPA é extremamente sensível a impurezas. Portanto, é preciso ter extremo cuidado ao preparar as amostras e realizar a técnica.
- Pode haver uma diminuição do sinal de uma sonda devido a um polimorfismo ou mutação raros, e pode ser necessário testá-la por outras técnicas.
MLPA é uma ótima técnica que pode ser usada para aplicações variadas e dá resultados de forma rápida e eficiente. No entanto, ela não vem sem soluços. Como todos sabemos, cada técnica tem certas desvantagens, e cada aplicação precisa ser cuidadosamente estudada, para ter certeza que estamos usando a técnica mais eficiente e sensível.
Você já usou MLPA? Qual a sua opinião sobre esta técnica?