Átomos e Ouro
Em 1911, Rutherford e os colegas Hans Geiger e Ernest Marsden iniciaram uma série de experiências revolucionárias que mudariam completamente o modelo aceite do átomo. Eles bombardearam folhas muito finas de folha de ouro com partículas alfa de movimento rápido.

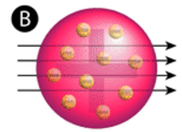

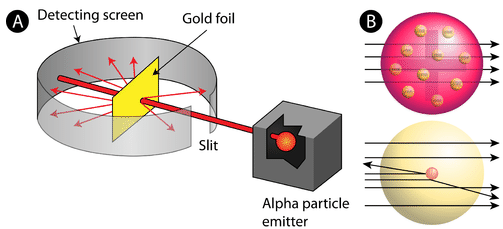
Figure \(\PageIndex{2}) (A) A configuração experimental para a experiência da folha de ouro de Rutherford: Um elemento radioativo que emitia partículas alfa era direcionado para uma fina folha de folha de ouro que era cercada por uma tela que permitiria a detecção das partículas defletidas. (B) De acordo com o modelo de pudim de ameixa (topo) todas as partículas alfa deveriam ter passado através da folha de ouro com pouca ou nenhuma deflexão. Rutherford descobriu que uma pequena porcentagem de partículas alfa era desviada em grandes ângulos, o que poderia ser explicado por um átomo com um núcleo muito pequeno, denso e com carga positiva em seu centro (inferior).
De acordo com o modelo atômico aceito, no qual a massa e a carga de um átomo são uniformemente distribuídas por todo o átomo, os cientistas esperavam que todas as partículas alfa passassem através da folha de ouro com apenas uma leve deflexão ou nenhuma. Surpreendentemente, como mostra a Figura 2 (PageIndex) (enquanto que a maioria das partículas alfa não eram de facto deformadas, uma percentagem muito pequena (cerca de 1 em 8000 partículas) saltava da folha de ouro em ângulos muito grandes. Algumas foram até redireccionadas de volta para a fonte. Nenhum conhecimento prévio as tinha preparado para esta descoberta. Em uma famosa citação, Rutherford exclamou que era “como se você tivesse disparado uma casca de 15 polegadas em um pedaço de tecido e ele voltou e bateu em você”
Rutherford precisava inventar um modelo totalmente novo do átomo para explicar seus resultados. Como a grande maioria das partículas alfa tinha passado pelo ouro, ele raciocinou que a maior parte do átomo era espaço vazio. Em contraste, as partículas que eram altamente desviadas devem ter experimentado uma força tremendamente poderosa dentro do átomo. Ele concluiu que toda a carga positiva e a maioria da massa do átomo deve estar concentrada num espaço muito pequeno no interior do átomo, ao qual ele chamou o núcleo. O núcleo é o núcleo central minúsculo e denso do átomo e é composto por prótons e nêutrons.
O modelo atômico de Rutherford ficou conhecido como o modelo nuclear. No átomo nuclear, os prótons e nêutrons, que compreendem quase toda a massa do átomo, estão localizados no núcleo no centro do átomo. Os elétrons estão distribuídos ao redor do núcleo e ocupam a maior parte do volume do átomo. Vale a pena enfatizar quão pequeno é o núcleo em comparação com o resto do átomo. Se pudéssemos explodir um átomo do tamanho de um grande estádio profissional de futebol, o núcleo teria o tamanho de um mármore.
O modelo de Rutherford provou ser um passo importante para uma compreensão completa do átomo. No entanto, não abordava completamente a natureza dos electrões e a forma como ocupavam o vasto espaço à volta do núcleo. Por este e outros insights, Rutherford foi agraciado com o Prêmio Nobel de Química em 1908. Infelizmente, Rutherford teria preferido receber o Prêmio Nobel de Física porque ele considerava a física superior à química. Na sua opinião, “Toda a ciência é física ou recolha de selos”